Реакция - гидролиз - этилацетат
Cтраница 1
Реакция гидролиза этилацетата СН3СООС2Н5 Н2О СН3СООН С2Н5ОН ускоряется ионами водорода. [1]
Прежде чем закончить обсуждение реакции гидролиза этилацетата, которую мы избрали в качестве примера, нужно сделать два важных дополнительных замечания. Поскольку при рН 5 начинается отщепление одного из протонов, изменение свободной энергии по мере повышения рН становится все более отрицательным; на единицу рН оно составляет AG - 2, 3 - 1, 99 - 298 lg 10 - 1364 кал / молъ. К этому замечанию мы еще вернемся позднее. Во-вторых, изменение свободной энергии в этой реакции зависит не только от относительных концентраций исходных веществ и продуктов реакции, но также и от их абсолютных концентраций. Bbmie было показано, что если все компоненты находятся в стандартном состоянии при 25, то величина AG0 равна - 4760 кал / моль. [2]
Соотношение Хаметта подтверждается также для реакции гидролиза этилацетата в присутствии соляной кислоты, гидролиза цианамида азотной кислотой, гидролиза сахарозы в присутствии НСЮ4, H2SO4, НС1, НМО3 при концентрациях кислот от 0 1 до 7 0 мол / л и ряда других реакций. [3]
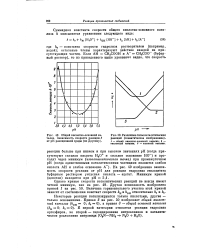
На рис. 49 изображена зависимость скорости реакции от рН для реакции гидролиза этилацетата буферным раствором уксусная кислота - ацетат. [5]
 |
Схема установки для изучения скорости этерификации в паровой фазе. [6] |
Нами избраны6 в качестве основного кинетического объекта исследования реакция этерификации ( получение этилацетата из уксусной кислоты и этилового спирта) и обратная ей реакция гидролиза этилацетата. [7]
Вместо того чтобы вводить концентрацию воды в выражение для константы равновесия реакций, протекающих в водном растворе, активность воды обычно считают равной единице. Если переписать выражение для константы равновесия реакции гидролиза этилацетата, приняв активность воды равной единице, а не 55 М, то константа равновесия будет равна 0 33 - 55 18, а изменение стандартной свободной энергии при 25 составит - 1710 кал / моль: ДС RT In 18 ( - RT In 10) lg 18, - 1710 кал. [8]
Стандартные свободные энергии гидролиза эфиров аминокислот, являющихся важными промежуточными продуктами при биосинтезе белков, сравнимы с энергией гидролиза АТФ. Следует отметить, что, например, свободная энергия гидролиза этилового эфира глицина до свободной аминокислоты составляет почти такую же величину, как и AG реакции гидролиза этилацетата. [9]
Расчет изменений стандартной свободной энергии на основании измерения константы равновесия и уравнения (11.22) на первый взгляд не является тривиальным. Для реакций, включающих отщепление или присоединение протона ( весьма обычных в биохимических процессах), такие расчеты могут быть выполнены тремя разными способами, причем все три способа правильны. Первой измеренной константой равновесия была константа равновесия реакции гидролиза этилацетата, определенная Бертло и Гиле-сом в 1863 г. На примере этой реакции можно рассмотреть все три способа, используемых для подсчета изменений стандартной свободной энергии. [10]
По мнению авторов, эти результаты указывают на преобладающую роль в данной реакции изотопного индуктивного эффекта, передаваемого через ароматическое ядро. Такое предположение кажется вполне логичным, однако полученные результаты все же противоречат данным Бендера и Фенга по изотопным эффектам в реакции гидролиза этилацетата. [11]
Страницы: 1