Реакция - горение - метан
Cтраница 1
 |
Сжигание метана в цилиндре. [1] |
Реакция горения метана может быть показана в следующих вариантах. [2]
Для реакции горения метана необходим не только нагрев до предельной температуры, но и определенное время для саморазгона предпламенной реакции. [3]
Требуется определить значение константы равновесия реакции горения метана в кислороде СН4 2О2 СО2 2Н2О при температуре 950 С. [4]
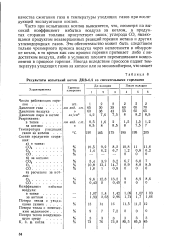 |
Результаты испытаний котла ДКВ-65 со смесительными горелками. [5] |
Часто при испытаниях котлов выясняется, что, несмотря на высокий коэффициент избытка воздуха за котлом, в продуктах сгорания топлива присутствует окись: углерода СО, являющаяся продуктом незавершенных реакций горения метана и других углеводородных газов. Это обстоятельство может быть следствием только чрезмерного присоса воздуха через неплотности в обмуровке котла, в то время как сам процесс горения протекает либо с недостатком воздуха, либо в условиях плохого перемешивания компонентов в процессе горения. [6]
Очень часто при испытаниях котлов выясняется, что, несмотря на высокий коэффициент избытка воздуха за котлом, в продуктах сгорания топлива присутствует окись углерода СО, являющаяся продуктом незавершенных реакций горения метана и других углеводородных газов. Это обстоятельство может быть следствием только чрезмерного Присоса воздуха через неплотности в обмуровке котла, в то время как сам процесс горения протекает либо с недостатком воздуха, либо в условиях плохого перемешивания компонентов в процессе горения. В этих случаях с помощью несложных замеров содержания кислорода в дымовых газах по тракту котельной можно точно установить величину присосов воздуха, выяснить истинную причину указанных явлений и принять меры к их недопущению. [7]
На сжигание 4 л смеси расходуется 19 л воздуха, содержащего 19 0 2 3 8 л кислорода. Из уравнений реакций горения метана, моноксида углерода и водорода видно, что для сжигания моноксида углерода и водорода нужно в 2 раза меньше кислорода, а для сжигания метана - в 2 раза больше. [8]
Рассмотрим еще один пример применения закона Гесса. Для вычисления запишем реакцию горения метана сначала непосредственно, а затем разбив на стадии. [9]
Рассмотрим еще один пример применения закона Гесса. Для вычисления запишем реакцию горения метана сначала непосредственно, а затем, разбив на стадии. [10]
Рассмотрим еще один пример применения закона Гесса. Для вычисления запишем реакцию горения метана сначала непосредственно, а затем разбив на стадии. [11]
Рассмотрим еще один пример применения закона Гесса. Для вычисления запишем реакцию горения метана сначала непосредственно, а затем разбив на стадии. [12]
Рассмотрим еще один пример применения закона Гесса. Для вычисления запишем реакцию горения метана сначала непосредственно, а затем разбив на стадии. [13]
Рассмотрим еще один пример применения закона Гесса. Для вычисления запишем реакцию горения метана сначала непосредственно, а затем разбив на стадии. [14]
По этим реакциям легко определить необходимое для горения количество воздуха, а также количество и состав продуктов горения, получающихся в результате сгорания газа. Например, из уравнения реакции горения метана видно, что для сжигания одного объема метана требуется 9 52 объема воздуха, и в результате реакции горения получится 10 52 объема продуктов горения. [15]
Страницы: 1 2