Реакция - дегидрирование - бутан
Cтраница 2
Так же как для этана и пропана, с повышением температуры растет константа равновесия реакции дегидрирования бутана. Уже при 550 по равновесию свыше половины всего количества бутана должно подвергнуться дегидрированию. Однако скорости двух первых реакций выше, и равновесие не достигается. При более высоких температурах удельный вес реакции дегидрирования, как и следовало ожидать, возрастает. [16]
Показано, что при увеличении содержания Сг2О3 от 2 до 12 5 % активность катализатора в реакции дегидрирования бутана возрастает. Добавка в определенных количествах ( 1 - 2 %) окисей щелочных и щелочно-земельных металлов повышает выход бутилена и избирательность и улучшает стабильность катализаторов; дальнейшее увеличение содержания промотора приводит к ускорению углеобразования. [17]
Разность уровней 1 - 2 представляет собой энергию адсорбции бутана, 7 - 5 - тепловой эффект реакции дегидрирования бутана. [19]
Приведенные данные можно интерпретировать таким образом, что гетерогенный фактор по-разному влияет на различные направления распада, но ускоряет только реакцию дегидрирования бутана, которая, по-видимому, не имеет отношения к развитию цепного процесса. Остальные реакции замедляются при увеличении гетерогенного фактора, и, следовательно, гетерогенное зарождение радикалов играет незначительную роль. [20]
 |
Проверка уравнения ( 7 для. [21] |
Интересно отметить, что значения отношения ks j kt, вычисленные по уравнениям ( 6) и ( 7) из данных для различных реакций, близки по порядку величины, что согласуется с предположением об идентичности механизма реакций дегидрирования бутана и бутилена. [22]
Реакция дегидрирования бутана приводит к образованию смеси изомеров бутилена. Тепловой эффект реакции дегидрирования бутана при 25 в а-бутилен равен 30 1 ккал / моль, в - ifHC - бутилен - - 28 5 и в - транс-бутилен - 27 45 ккал / моль. [23]
 |
Зависимость равновесной концентрации аммиака, от температуры Т при давлениях 10 МПа ( 7 и 30 МПа ( 2. [24] |
Разбавление реакционной смеси - добавление инертного вещества - равнозначно уменьшению давления. Покажем это на примере реакции дегидрирования бутана до бутилена С ю C4Hg Н2, протекающей с увеличением объема реакционной смеси. [25]
 |
Зависимость равновесной концентрации аммиака С от давления Р при температурах 673 К ( Г и 773 К ( 2. [26] |
Добавление инертного вещества оказывает действие, равнозначное уменьшению давления. Рассмотрим это влияние на примере реакции дегидрирования бутана до бутилена С4Н10 С4Н8 Н2, протекающей с увеличением объема реакционной смеси. [27]
Уравнение ( 7) не зависит от кинетики реакции. Расчет по уравнению ( 7) показал, что в температурном интервале 510 - 550 С реакция дегидрирования бутана в наших условиях протекает в кинетической области, а при 570 С имеет место внутридиффузионное торможение, что приводит к резкому снижению энергии активации. Необходимо отметить, что наблюдаемая энергия активации при внутридиффузионном торможении не равна половине энергии активации реакции в кинетической области. [28]
 |
Реакции получения алкенов дегидрированием алканов. [29] |
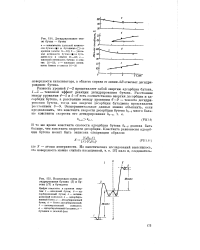
На рис. 1 представлена зависимость константы равновесия пяти реакций от обратной величины температуры. Эта зависимость имеет вид прямых линий, расходящихся при низких температурах. Отклонение существенно IB случае реакции с участием метана, : в меньшей степени изменяется реакция с участием этана, а логарифмы констант равновесия реакций дегидрирования бутана и пентана практически совпадают при всех температурах. Легче всего протекает реакция дегидрирования пропана с образованием пропилена. Все прямые пересекают нулевое значение логарифма константы равновесия при температурах 1670, 1100, 940 и 930 К, для реакций 1, 2, 4 - 5 и 3 соответственно. [30]
Страницы: 1 2 3