Стабильные димер
Cтраница 1
Стабильные димеры образуются также при облучении соединений, имеющих двойные связи в циклич. [1]
Геометрия переходного состояния 16 вблизи реакционного центра имеет много общего с геометрией стабильных димеров карбоновых кислот. Это подобие наводит на мысль, что в реакциях, сходных с мутаротацией, карбоно-вые кислоты могут образовывать переходные состояния с относительно низким стандартным потенциалом, В таких переходных состояниях карбонильный кислород кислоты принимает протон от одного положения молекулы субстрата, а гидроксильная группа кислоты предоставляет протон другому положению. И действительно, для мутаротации глюкозы в бензольных [34] или нитромета-новых [35] растворах карбоновые кислоты - значительно более эффективные катализаторы, чем фенолы с той же кислотностью. Несомненно, что в водных растворах такие переходные состояния менее важны, так как вода способна быть и донором, и акцептором протона. Окси-пиридин ускоряет мутаротацию глюкозы в водном растворе только в 4 - 5 раз сильнее, чем можно было ожидать из его кислотных и основных свойств. [2]
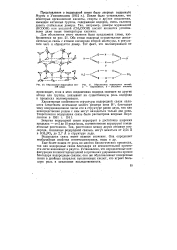 |
Образование водородных евя - [ IMAGE ] Образование водородных связей. зей ( лед а - муравьиная. б - уксусная кислоты. [3] |
Позже было установлено, что некоторые органические кислоты, спирты и другие соединения, имеющие активные группы, содержащие водород, очень склонны давать стабильные димеры. Так, например, димеры муравьиной ( НСООН) или уксусной ( СН3СООН) кислот являются устойчивыми даже выше температуры кипения. [4]
Концепция резонанса была также использована Полингом [30] для объяснения стабильности молекул с нечетным числом электронов, даже если, согласно элементарной теории, для них следовало бы ожидать образования стабильных димеров. [5]
Ароматические, алкепильные и алкинильные мостиковые группы придают дополнительную стабильность трехцентровой связи. Так, диалкилалкенилалаиы образуют стабильные димеры с ви-нильным мостиком, не диссоциирующие при температурах ниже 100 С. [6]
Фриш и Виллис [203] нашли, что присутствие стабильных димеров увеличивает скорость образования критических зародышей за счет увеличения поверхности димеров по сравнению с поверхностью одиночных молекул. Однако, как показали Катц и др. [204], кинетический эффект, только частично учтенный в работе Фриша и Виллиса, почти всегда пренебрежим, тогда как описываемое экс-понентой изменение равновесного распределения кластеров вследствие наличия стабильных димеров сильно уменьшает скорость образования критических зародышей. [7]
 |
Зависимость температур плавления гидридов от состава. [8] |
Водородная связь первоначально была открыта в жидкостях и газах. Было установлено, что некоторые органические кислоты, спирты и другие соединения, имеющие активные группы, содержащие водород, очень склонны давать стабильные димеры. Так, например, димеры муравьиной или уксусной кислот являются устойчивыми даже выше температуры кипения. [9]
 |
Зависимость температур плавления гидридов от состава. [10] |
Водородная связь была открыта в конце XIX в. Было установлено, что некоторые органические кислоты, спирты и другие соединения, имеющие активные группы, содержащие водород, очень склонны давать стабильные димеры. Так, например, димеры муравьиной или уксусной кислот являются устойчивыми даже выше температуры кипения. [11]
Фриш и Виллис [203] нашли, что присутствие стабильных димеров увеличивает скорость образования критических зародышей за счет увеличения поверхности димеров по сравнению с поверхностью одиночных молекул. Однако, как показали Катц и др. [204], кинетический эффект, только частично учтенный в работе Фриша и Виллиса, почти всегда пренебрежим, тогда как описываемое экс-понентой изменение равновесного распределения кластеров вследствие наличия стабильных димеров сильно уменьшает скорость образования критических зародышей. [12]
Гидролиз неразбавленных низших алюмшшйтриалкилов является сильно экзотермической реакцией, и для его проведения требуются особые меры предосторожности. Превращение алюмшпшорганических соединений в эфирагы при разбавлении эфиром понижает их активность при взаимодействии с протонодонорпыми реагентами. Ллкоголнз алю-мпнийорганических соединений метанолом или этанолом также протекает более спокойно, чем гидролиз. При реакции алюми-нийтриалкнлов с третичными спиртами отщепляется лишь одна алкильная группа, и образуются стабильные димеры диалкилалю-минии-грег-алкоксндов. [13]
Страницы: 1