Значение - реальный потенциал
Cтраница 1
Значение реального потенциала зависит также от потенциала жидкостного соединения, возникающего между электродом сравнения и исследуемым полуэлемснгом. [1]
Значения реальных потенциалов пар Реш - Fe11 и CrVI - Сгга, найденные из кривых потенциометрического титрования, приведены в табл. 32 ( см. стр. Потенциал бихромата, как и следовало ожидать, обычно увеличивается с увеличением кислотности. Однако изменения, связанные с природой кислоты, в настоящее время не могут быть объяснены. Необходимо дальнейшее изучение этого вопроса, особенно в связи с исследованиями окисных пленок на инертной поверхности электрода. С практической точки зрения следует подчеркнуть, что скорость достижения электродного равновесия, особенно вблизи конечной точки или после нее, уменьшается с разбавлением. Тем не менее сама по себе реакция протекает количественно и достаточно быстро даже при предельном разбавлении. [2]
Широкий диапазон значений реальных потенциалов пары Се IV / CenI, зависящих от среды и концентрации лигандов, дает возможность использовать цериметрический метод для определения самых разнообразных веществ, не определяемых другими ред-окс-методами. [3]
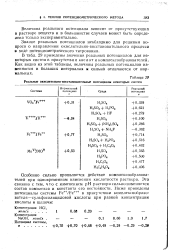
В табл. 14 приведены значения реальных потенциалов для некоторых систем в присутствии кислот и комплексообразователей. [4]
 |
Реальные окислительно-восстановительные потенциалы некоторых систем. [5] |
В табл. 11 приведены значения реальных потенциалов для некоторых систем в присутствии кислот и комплексообразователей. [6]
 |
Реальные окислительно-восстановительные потенциалы некоторых систем. [7] |
В табл. 29 приведены значения реальных потенциалов для некоторых систем в присутствии кислот и комплексообразователей. Как видно из этой таблицы, величины реальных потенциалов изменяются в больших интервалах и сильно отличаются от нормальных. [8]
В табл. 23 приведены значения реальных потенциалов для некоторых систем в присутствии кислот и комплексообразователей. [9]
Это обусловливается тем, что значения реальных потенциалов пар CeIV / Ceni и CrVI / Crm сильно меняются в зависимости от концентрации добавляемой фосфорной кислоты. [10]
Для вычисления констант равновесия в реальных условиях в эту формулу следует подставлять значения реальных потенциалов. [11]
Исследовано влияние природа и обратимости редокс-систем на реальные потенциалы МДО - и Т0 - образцов. Установлена корреляция значений стандартных и реальных потенциалов для МДО-образ-цов. Отмечена независимость потенциалов образцов от соотношения концентраций окисленной и восстановленной форм систем. [12]
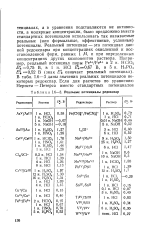 |
Реальные потенциалы редокспар. [13] |
В табл. 1.6 - 3 даны значения реальных потенциалов некоторых редокспар. [14]
Поэтому важно уяснить, что измерения с помощью электрода с низким водородным сверхпотенциалом дают погрешность, обусловленную возникновением смешанного потенциала. Грубе и Шлехт [89] применяли электрод из электролитически полученного олова; значения реального потенциала равны - 0 411 В в 0 0015 М серной кислоте и от - 0 386 до - 0 373 В в 0 1 М серной кислоте. [15]
Страницы: 1 2