Значение - нормальный электродный потенциал
Cтраница 1
Значение нормального электродного потенциала определяется природой электрода и может измениться только при изменении природы его поверхности. [1]
Значения нормальных электродных потенциалов находят в таблицах ( стр. [2]
Значение нормального электродного потенциала определяется материалом электрода и может измениться только при изменении природы его поверхности. [3]
Значение нормального электродного потенциала является величиной, характерной для данной электрохимической реакции и не зависящей от концентрации ионов в растворе. Она определяет способность реагирующего иона принимать или отдавать электроны. Чем больше абсолютная величина отрицательного нормального потенциала, тем сильнее стремление металла ( элемента) к ионизации, тем выше его восстановительная способность; с увеличением потенциала возрастает окислительная способность элементов. [4]
Значение нормального электродного потенциала - величина, характерная для данной электрохимической реакции и определяющая способность реагирующего иона принимать или отдавать электроны. [5]
Значения нормальных электродных потенциалов находят по таблицам ( см. стр. [6]
Значения нормальных электродных потенциалов приводятся в соответствующей справочной литературе. [7]
Используя значения нормальных электродных потенциалов Е0 для реакции типа 2Х - - Х2 2е, покажите, что для получения Вг2 из Вг и 12 из 1 - можно применять Glz, а для получения F2 из F - нельзя. [8]
По значениям нормальных электродных потенциалов эти металлы могут быть установлены в ряд: марганец ( - 1 180 в) - хром ( - 0 913 в) - железо ( - 0 44 в) - никель ( - 0 25 в) - медь ( 0 337 в) и др. Так как сплав имеет неоднородный химический состав и неравномерное распределение зерен металлов, составляющих сплав в его массе, а также различную ориентацию зерен в пространстве на поверхности газопровода, то в микромасштабе отдельные участки поверхности могут иметь различные потенциалы. Однако в макромасштабе на величину потенциала определяющее влияние оказывают другие факторы. [9]
По значениям нормальных электродных потенциалов можно рассчитать электродные потенциалы при любых концентрациях одноименных ионов в растворах, что имеет большое прикладное значение при составлении гальванических элементов. [10]
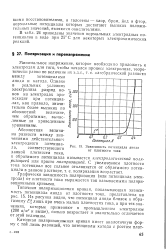 |
Зависимость потенциала анода от плотности тока. [11] |
В табл. 24 приведены значения нормальных электродных потенциалов в воде при 25 С для некоторых электрохимических реакций. [12]
Все элементы в ряде напряжения расположены в зависимости от их электрохимических свойств. Центральное положение со значением нормального электродного потенциала условно принятого за нуль, занимает4 водород. Выше водорода расположены электроотрицательные металлы со сравнительно большей упругостью растворения, повышающейся по на - правлению ж калию. Ниже водорода находятся электроположительные металлы. Каждый металл, расположенный в ряду выше, способен вытеснять из растворов их солей все нижестоящие металлы. Все электроотрицательные металлы способны вытеснять водород из кислот, а некоторые; ( К, Na) и из воды. [13]
Такие металлы как никель, свинец и олово, значение нормального электродного потенциала которых близко к значению нормального потенциала водорода, не выделяют заметных количеств водорода в соляной кислоте нормальной активности, если не привести их в контакт с платиновой чернью. Эти металлы в обычных условиях подобны более благородным металлам ( меди, серебру, платине и золоту) и могут считаться стойкими по отношению к большинству неокислительных кислот в отсутствии кислорода. В присутствии же кислорода в качестве деполяризатора коррозия обычно становится заметной, а в присутствии энергичных окислительных агентов - сильной. Уотте и Уиппль3 показали, что коррозия свинца, олова, меди и серебра в разбавленных кислотах сильно увеличивается в присутствии таких соединений как перекись водорода, перманганат калия, бихроматы или хлораты. [14]
Если бы не было побочных явлений на электродах, электролиз начинался бы при внешнем напряжении, очень незначительно превышающем разность электродных потенциалов. Однако протекание тока через электроды вызывает их поляризацию. На практике мы обнаруживаем поляризацию электрода, пропуская ток через раствор электролита. Для того чтобы начался процесс электролиза, необходимо приложить напряжение, заметно большее, чем это следует из значений нормальных электродных потенциалов. При этом потенциал анода может оказаться более положительным, а потенциал катода более отрицательным. Могут быть случаи, когда поляризован только один электрод. [15]
Страницы: 1