Последовательная необратимая реакция
Cтраница 1
Последовательные необратимые реакции удобно рассматривать по количеству ступеней и по количеству исходных веществ. [1]
В последовательной необратимой реакции исходное вещество и все промежуточные продукты реагируют только в одном направлении. [2]
Рассмотрим наиболее сложную последовательную необратимую реакцию в п ступеней, причем каждое участвующее в ней вещество ( кроме конечного) имеет некоторую концентрацию в начальный момент. [3]
В зерне происходят последовательные необратимые реакции превращения соды в сульфит натрия и сульфита натрия в пиросульфит натрия; твердофазные реакции в зерне отсутствуют. [4]
В 1928 г. опубликован расчет последовательной необратимой реакции в п ступеней с приведением практических примеров-расчета, в области радиоактивности в справочнике по. [5]
Легко решается задача расчета констант скоростей гомоген-ной последовательной необратимой реакции, проводимой в потоке. [6]
На основании этой серии расчетов установлена характерная для последовательных и необратимых реакций закономерность. При увеличении времени реакции концентрация метана снижается, количество формальдегида и окиси углерода увеличивается и достигает максимума, содержание двуокиси углерода в газе растет непрерывно. [7]
Сравнение показало, что общие закономерности, характерные для последовательных и необратимых реакций, не зависят от порядка реакции, определяющего количественное соотношение компонентов. [8]
Поставим теперь более сложную задачу - - определить состав продуктов последовательной необратимой реакции, идущей не в три ступени, как это было описано ранее, а в п ступеней. Остальные условия задачи прежние. [9]
Установлено, что кинетика электросинтеза перекиси водорода в цельно-стеклянном реакторе удовлетворительно описывается уравнениями последовательных необратимых реакций 1-го порядка. Электросинтез Н202 в стеклянно-металлических реакторах отвечает схеме параллельно-последовательных необратимых реакций 1-го порядка. [10]
Это позволили применить основные положения, изложенные в работе Н. Р. Родигина и Э. Н. Родигиной [79] для расчета состава газа и определения констант отдельных последовательных и необратимых реакций первого порядка в п ступеней. [11]
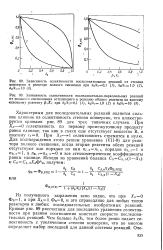
Из полученного выражения ясно видно, что при Х & 0 Фв1, а при д1 Фв0, и это справедливо для любых типов реакторов и любых последовательных необратимых реакций. Кривые рис. 89 рассчитаны для последнего уравнения селективности при разном соотношении констант скорости последовательных реакций. Чем больше k2 / ki, тем более резко падает селективность с увеличением степени конверсии, что во многом определяет выбор последней для данной системы реакций. [13]
Большая часть приведенных работ касается последовательных необратимых реакций и, как правило, реакций образования суммарного количества моно -, ди - и полиалкил-бензолов. [14]
Например, в простейшем случае двух последовательных необратимых реакций, в которых кинетика получения основного продукта В описывается уравнением 2-го порядка, а побочного продукта D - уравнением 1-го порядка, соотношение количеств В и D растет пропорционально начальной концентрации исходного реагента А. Соответственно увеличивается и избирательность. [15]
Страницы: 1 2