Простая необратимая реакция
Cтраница 1
Простые необратимые реакции при любых условиях полностью направлены в сторону образования продуктов реакции. [1]
Простые необратимые реакции протекают в одном направлении и без образования побочных продуктов. Объектом регулирования здесь может быть лишь скорость реакции. Естественно, что технолог всегда заинтересован в проведении реакции с максимальной скоростью, поскольку это увеличивает интенсивность работы аппаратуры. [2]
Для простых необратимых реакций оптимальной является постоянная максимально допустимая температура или же постепенное повышение температуры к концу реакции, чтобы отчасти компенсировать снижение скорости реакции, происходящее вследствие снижения ког центрации сырья. [3]
Скорость простой необратимой реакции возрастает с температурой ( рис. 4.8, а), и максимально возможная скорость реакции при любой степени превращения будет достигаться при максимально допустимой температуре Гтах, определяемой конкретным процессом. [4]
Для простых необратимых реакций основным критерием оптимальности является достижение максимальной скорости реакции при заданных конечной степени превращения и термостойкости катализатора. [5]
Для простых необратимых реакций оптимальным является изотермическое оперирование при наивысшей допустимой температуре в реакторе. [6]
Для простой необратимой реакции A - - R Q зависимость XA f ( T) выражается S-обратной кривой ( рис. II. По мере повышения температуры скорость реакции увеличивается экспоненциально в соответствии с уравнением (11.25), что приводит к резкому подъему кривой. Но с увеличением ХА концентрация исходного реагента уменьшается и соответственно снижается рост скорости реакции, поэтому функциональная зависимость ХА - f ( T) асимптотически приближается к единице. [7]
В случае простых необратимых реакций наибольшая скорость превращения и, следовательно, самая высокая производительность могут быть достигнуты при максимально допустимой ( по экономическим и техническим соображениям) температуре. В таких случаях решающим фактором для выбора температуры может оказаться мощность аппаратов охлаждения и нагревания. [8]
Рассмотрим кинетику простых необратимых реакций, в которых присутствие продуктов не влияет на ход рассматриваемой реакции. [9]
В последующем изложении термин кинетически простая необратимая реакция будет означать такую реакцию, скорость которой в пределах точности приближения разбавленных растворов пропорциональна произведению концентраций в некоторых степенях. Эти степени могут быть положительными, отрицательными, равными нулю или даже дробными. [10]
В отличие от этого коэффициент эффективности простой необратимой реакции в изотермических условиях не зависит от характера последующих превращений. Исключение составляют случаи, когда продукты реакции могут оказывать влияние на коэффициент диффузии вещества А или каким-либо путем изменять истинную активность катализатора. [11]
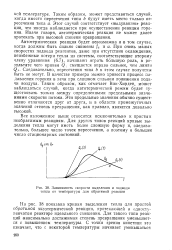 |
Зависимость скорости выделения и подвода тепла от температуры для обратимой реакции. [12] |
Все изложенное выше относится исключительно к простым необратимым реакциям. Для других типов реакций кривые выделения тепла могут иметь более сложную форму и, следовательно, большее число точек пересечения, а поэтому и большее число стационарных состояний. [13]
Чтобы использовать это уравнение по отношению к простой необратимой реакции A - - R - f - Q, его составляют по одному из компонентов реакционной смеси ( любому) и вводят в него дополнительные члены, учитывающие отвод тепла в результате теплообмена и тепло реакции. [14]
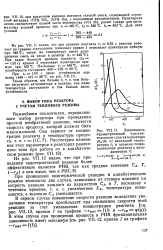 |
Зависимость параметрической чувстви. [15] |
Страницы: 1 2