Обратимая реакция - второе - порядок
Cтраница 3
 |
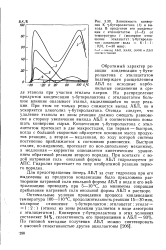
Кинетическая кривая накопления. тилацетата ( 1 и ее полулогарифмическая анаморфоза ( 2 для обратимой реакции второго порядка ( А0 0 055 моль / л. В0 0 186 моль / л. C. [31] |
В согласии с ожидаемым, как видно из рис. V.4, кинетическая кривая накопления этилацетата хорошо спрямляется в полулогарифмических координатах для обратимой реакции второго порядка. [32]
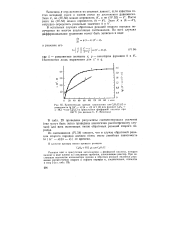 |
Кинетическая кривая накопления нзо - С3Н7С1 ( / н. [33] |
В табл. 29 приведены результаты соответствующих расчетов ( они могут быть легко проведены аналогично рассмотренному случаю) для всех возможных типов обратимых реакций второго порядка. [34]
Спонтанная реакция в стехиометрической смеси отвечает второму порядку как в нитробензоле ( раздел А), так и п-ксилоле ( раздел Б); именно об этом свидетельствует постоянство константы скорости, вычисленной по кинетическому уравнению обратимых реакций второго порядка. [35]
Имеется много типов подобных систем. Примерами обратимых реакций второго порядка служат газофазное разложение HI ( 2HI - H2 I2) [7], реакции атомов с молекулами [8] и реакции замещения между ионами ( такими, как I) и алкилгалоидами [9] в неводном растворе. [36]
Обратимые реакции широко распространены и могут быть различных порядков. Примером обратимой реакции второго порядка могут служить реакции омыления и этерификации сложных эфиров. [37]
Имеется много типов подобных систем. Примерами обратимых реакций второго порядка служат газофазное разложение HI ( 2HIj H2 I2) [7], реакции атомов с молекулами [8] и реакции замещения между ионами ( такими, как I) и алкилгалоидами [9] в неводном растворе. [38]
Было показано, что стадия гидролиза эфира до лактола и этилового спирта значительно медленнее стадии дециклизации лактола. В этой системе увеличение предельного тока восстановления цис-фор-милакриловой кислоты во времени определяется скоростью гидролиза эфира. На основании кинетического уравнения обратимой реакции второго порядка [ уравнение ( 206), рис. 76 ] были найдены [254] константы скорости этой стадии. [39]
На распределение продуктов конденсации - у-бутиролактона с этилацетатом большое влияние оказывает этанол, выделяющийся по ходу реакции. При этом не только резко снижается выход АБЛ, но и ускоряется алкоголиз - у-бутиролактона. Отсюда следует, что удаление этанола из зоны реакции должно смещать равновесие в сторону увеличения выхода АБЛ и соответственно повышать конверсию сырья. Конденсация у-бутиролактона с этил-ацетатом протекает в две макростадии, где первая - быстрая, когда с большой скоростью образуется основная масса продуктов реакции, а вторая - медленная, по ходу которой система постепенно приближается к состоянию равновесия. Быстрая стадия, по-видимому, протекает по ион-дипольному механизму, а медленная - корректно описывается кинетическим уравнением обратимой реакции второго порядка. При контакте с водой натриевая соль енольной формы АБЛ гидролизуется до АПС. Гидролиз протекает по типу необратимой реакции первого порядка. [41]
Страницы: 1 2 3