Любая каталитическая реакция
Cтраница 1
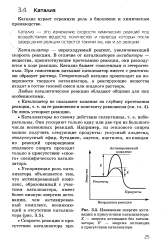 |
Изменение энергии активации в присутствии катализатора. Е - энергия активации без катализатора. Е - энергия активации в присутствии катализатора. [1] |
Любые каталитические реакции обладают общими для них особенностями. [2]
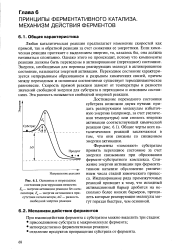 |
Основное и переходное состояния реагирующих веществ. Е0 - энергия активации реакции без катализатора. Ек - энергия активации в присутствии катализатора. AG - разность свободной энергии реакции. [3] |
Любая каталитическая реакция предполагает изменение скоростей как прямой, так и обратной реакции за счет снижения ее энергетики. Если химическая реакция протекает с выделением энергии, то, казалось бы, она должна начинаться спонтанно. Однако этого не происходит, потому что компоненты реакции должны быть переведены в активированное ( переходное) состояние. Энергия, необходимая для перевода реагирующих молекул в активированное состояние, называется энергией активации. Переходное состояние характеризуется непрерывным образованием и разрывом химических связей, причем между переходным и основным состояниями существует термодинамическое равновесие. Скорость прямой реакции зависит от температуры и разности значений свободной энергии для субстрата в переходном и основном состояниях. Эта разность называется свободной энергией реакции. [4]
Любая каталитическая реакция состоит по меньшей мере из нескольких стадий. [5]
Почти для любой каталитической реакции повышением температуры можно добиться столь высокой скорости химического превращения, что оно начинает тормозиться транспортом вещества. [6]
Имеющиеся наблюдения позволяют любую каталитическую реакцию окисления рассматривать как сочетание реакций двух типов: 1) реакции, развивающейся каталитически, и 2) реакции с ярко выраженным цепным механизмом. Катализатор, таким образом, ускоряет лишь образование первичных радикалов, являющихся, как известно, инициаторами цепного процесса окисления. [7]
Ввиду того что в любой каталитической реакции по меньшей мере один из реагентов хемосорбирован, теорию катализа можно создать лишь после выяснения механизма хемосорб-ции. В последние годы в результате успехов физики твердого тела стало очевидно, что важная группа адсорбентов и катализаторов, а именно окислы переходных металлов, относится к типичным полупроводникам. [8]
Это определение предусматривает, следовательно, два обстоятельства: 1) любая каталитическая реакция может протекать и без катализатора, только медленнее или быстрее, чем с катализатором; 2) катализатор может как ускорять, так замедлять реакцию. [9]
Как видно из вывода, этот принцип может быть распространен на любую каталитическую реакцию, протекающую по стадийному механизму, и использован при подборе катализаторов. Однако простота нашего вывода кажущаяся. Она вызвана некоторой некорректностью положенного в основу условия оптимума каталитической активности. В действительности таким условием является не равенство изменений свободных энергий Af7 JA, , а равенство констант скоро - стей этик стадий Kj Kg. Следовательно, в нашем условии было скрыто утверждение, что константы скорости линейно зависят от изменения свободной энергии химического процесса. В общем случае это неверно. Так как в уравнения термодинамики фактор времени не входит, между термодинамическими характеристиками явная связь как правило должна отсутствовать. Однако для многих типов химических реакций связь наблюдается. [10]
Энергия связи катализатора с взаимодействующими на его поверхности атомами оказывает влияние на осуществление любых каталитических реакций. Величины энергий связи атомов, участвующих в реакции, с активными центрами катализатора Qa-к являются важнейшими характеристиками системы, так как они учитывают специфику как реагирующих молекул, так и активной поверхности катализатора. Очевидно в частном случае каталитического крекинга - при более прочной связи атомов углерода, которые являются источником образования кокса, с металлами, они будут дольше удерживаться на поверхности катализатора, и это будет способствовать увеличению коксообразования. [11]
При изучении механизма каталитической изомеризации углеводородов, в частности цикланов, те следует игнорировать, как и в любых каталитических реакциях, свойства самого катализатора. [12]
При изучении механизма каталитической изомеризации углеводородов, в частности цикланов, не следует игнорировать, как и в любых каталитических реакциях, свойства самого катализатора. [13]
 |
Влияние концентрации катализатора Скат на выходе продукта х при ( Т, Р const. Bpe. [14] |
Влияние концентрации реагирующих веществ, температуры и перемешивания на скорость гомогенной каталитической реакции подчиняется общим законам. Скорость любой каталитической реакции во многом зависит от активности применяемого катализатора и его концентрации. [15]
Страницы: 1 2