Анодная реакция
Cтраница 2
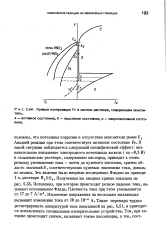 |
Кривые поляризации Fe в кислом растворе, содержащем-окислитель. [16] |
Анодной реакции при этом соответствует активное состояние Fe. В) в сильнокислом растворе, содержащем кислород, приводит к очень резкому уменьшению тока - почти до нулевого значения, причем область значений Е, соответствующих нулевым значениям тока, довольно велика. Полученная им анодная кривая показана на рис. 5.55. Потенциал, при котором Происходит резкое падение тока, называют потенциалом Флада. Изменение напряжения на несколько милливольт вызывает изменение тока от 10 до 10 - б А. Такие перепады трудно регистрировать аппаратурой типа показанной на рис. 5.51, и приходится использовать специальные измерительные устройства. [17]
Анодным реакциям координационных соединений металлов, содержащих органические лиганды, уделено значительно меньше внимания, чем процессам восстановления. Вероятно, причина этого состоит в том, что ртутный капающий электрод обладает сравнительно ограниченной доступной областью потенциалов поляризации. Использование же менее удобных в смысле воспроизводимости поверхности твердых электродов для этих целей началось сравнительно недавно. В последнее время наблюдается повышенный интерес к изучению анодных процессов разнообразных комплексов, особенно в органических растворителях, и промежуточных частиц или неустойчивых катионов, генерируемых на анодах различной природы. При анодном окислении металлокомп-лексов отрыв электрона может происходить как с орбит центрального атома, так и с молекулярных орбиталей, имеющих лигандный характер. Образующиеся продукты имеют различную устойчивость. Полезную информацию о строении этих частиц чаще всего получают с помощью ЭПР-спектроскопии. [18]
Анодной реакцией является ионизация железа. [19]
Простейшими анодными реакциями, по-видимому, являются те, в результате которых образующиеся растворимые гидрати-рованные или комплексные катионы отводятся непосредственно от анода путем диффузии, миграции или конвекции. При этом катионы не должны осаждаться или накопляться в количестве, достаточном для появления заметной концентрационной поляризации. [20]
Лимитирующая анодная реакция в растворах галогенидов включает окисление иона галогена. В растворах пикратов и перхлоратов на графитовом, а также платиновом электроде образуется коричневый продукт. По цвету это соединение похоже на продукт окисления пиридина персульфатом, который представляет собой соль N-пиридилпиридина. [21]
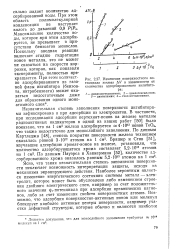 |
Изменение поверхностного потенциала железа ДУ в зависимости от количества адсорбированного ингибитора. 1 - дициклогексиламин. 2 - циклогексиламин. 3 - диэтиламин. 4 - гексаметиленимнн. [22] |
Поскольку анодная реакция включает стадию гидратации ионов металла, это не может не сказаться на скорости коррозии, которая, как показали эксперименты, полностью прекращается. [23]
Лимитирующая анодная реакция в растворах галогенидов включает окисление иона галогена. В растворах пикратов и перхлоратов на графитовом, а также платиновом электроде образуется коричневый продукт. По цвету это соединение похоже на продукт окисления пиридина персульфатом, который представляет собой соль N-пиридилпиридина. [24]
Эта новая анодная реакция дймеризации исчерпывает схему, приведенную на стр. [25]
Эта новая анодная реакция димеризации исчерпывает схему, приведенную на стр. [26]
Скорость анодной реакции на германии - типа лимитируется концентрацией дырок на границе раздела с электролитом. Поэтому эффект местного травления может быть усилен, если на отдельных участках поверхности полупроводника создавать избыточную концентрацию неосновных носителей тока путем интенсивного местного освещения или инъекцией дырок р - - переходом. Лучи света фокусируются на одной стороне германиевой пластины, погруженной в электролит. При подаче на германий анодного напряжения на обеих сторонах пластинки образуются соосные углубления. На противоположной стороне пластины углубление возникает из-за того, что некоторое количество квантов света проникает очень глубоко в германий и вызывает там образование пар электрон-дырка. Кроме того, некоторая часть дырок, образовавшихся на освещенном участке поверхности, диффундирует через пластинку. [27]
Примером анодной реакции является электролитич. [28]
Протекание анодных реакций в тонких слоях имеет свои специфические особенности. Если обратиться к табл. 19, то легко заметить, что уже при незначительном сдвиге потенциала от стационарного значения, кроме реакций, рассмотренных выше, на аноде могут протекать и реакции электрохимического окисления меди ионами Cl -, SCu2 - и СОз2 - с образованием хлоридов, сульфатов и карбонатов в результате не вторичных процессов, а первичного электрохимического акта. Образующиеся соединения, очевидно, не обладают защитными свойствами. Впрочем, хлориды, сульфаты, карбонаты и гидраты когут образовываться и в результате вторичных реакций за счет взаимодействия перешедших в раствор ионов меди с анионами. Эти соединения, не обладая защитными свойствами, тем не менее оказывают косвенное влияние на процесс наступления пассивного состояния. [29]
Зависимость анодной реакции по уравнению ( 2.54 а) от потенциала с избытком компенсируется образованием ионов ОН - на катоде, так что скорость растворения алюминия по уравнению реакции (2.546) повышается по мере снижения потенциала, и катодная защита оказывается уже невозможной. В водах, бедных щелочными ионами, потенциал Us может быть более отрицательным. В отношении коррозии в средах, не содержащих щелочных ионов, алюминиевые сплавы должны принадлежать к группе I. [30]
Страницы: 1 2 3 4