Фотохимическая реакция
Cтраница 3
Фотохимические реакции отличаются малыми температурными коэффициентами скорости. [31]
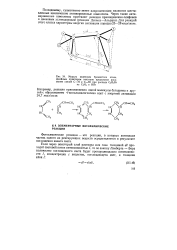 |
Модель молекулы бромистого этила. Двойным пунктиром показано предельное искажение связей С - Н и С-Вг при распаде C2HsBr на С2Н4 и НВг. [32] |
Фотохимические реакции - это реакции, в которых активация частиц одного из реагирующих веществ осуществляется в результате поглощения кванта света. [33]
Фотохимические реакции могут иметь различный характер и подразделяются на две основные группы. К первой группе относятся реакции, термодинамически способные к самопроизвольному протеканию в данных условиях. Для этих реакций свет играет роль инициатора. Далее реакция протекает без подвода энергии извне. Такие реакции называются фотокаталитическими и протекают, как правило, по цепному механизму. [34]
Фотохимические реакции, вызываемые или ускоряемые действием световой энергии, происходят как в природе, так и в промышленности. Хлорирование и бромирование углеводородов, синтез полистирола, сульфохлорирование парафинов, а также фотосинтез с помощью хлорофилла относятся к разряду таких процессов. [35]
Фотохимические реакции могут быть использованы также для осаждения многих металлов из растворов их солей. Облучая растворы, содержащие этанол, винную или муравьиную кислоту и ряд других веществ, можно осаждать такие металлы, как медь, серебро, ртуть, золото, платиновые металлы, а также селен и теллур. [36]
Фотохимические реакции могут быть использованы и для демаскирования ионов металлов путем фотохимического разрушения комплексообразующих веществ. [37]
Фотохимические реакции можно разделить на прямые и сенсибилизированные. В прямой фотохимической реакции одно или более веществ, вступающих в реакцию, поглощают свет. В сенсибилизированной реакции какое-либо вещество поглощает свет и вызывает реакцию, в которой оно не участвует в качестве одной из исчезающих молекул. Примерами сенсибилизированных реакций могут быть: гидрирование этилена в присутствии паров ртути с применением излучения, поглощаемого только парами ртути; рост растений, обусловленный излучением, которое поглощается хлорофиллом, несмотря на то, что последний не подвергается определенному химическому изменению; окисление тетрахлор-этилена в хлорангидрид трихлоруксусной кислоты в присутствии хлора и света, поглощаемого только хлором. [38]
Фотохимические реакции протекают в соответствия. [39]
Фотохимическая реакция может иметь 1 - й порядок при малом поглощении света реакционной средой. Энергия активации в растворе по сравнению с энергией активации реакции в газовой среде может уменьшаться, увеличиваться или не меняться в зависимости от соотношения между тепло-тами сольватации активированного комплекса и исходных веществ. [40]
Фотохимические реакции имеют много общего с обычными химическими реакциями. Для них, так же как и для темновых реакций, требуется определенное предварительное возбуждение ( активация) молекул, после чего последние вступают в химическое взаимодействие. Принципиальное отличие состоит в том, что в фотохимических реакциях молекулы возбуждаются за счет лучистой энергии, а в обычных темновых реакциях - за счет других источников, например нагревания. [41]
Фотохимическая реакция сильно тормозится даже небольшими примесями кислорода, причем расходования кислорода не наблюдается, что, по-видимому, связано с образованием нестойких соединений, таких, как СЮ2 или С2Н4СЮ2, распадающихся затем с выделением кислорода и без восстановления атома хлора. [42]
Фотохимические реакции отличаются значительно меньшей зависимостью скорости от температуры, чем темновые химические процессы. Это объясняется тем, что за счет поглощения света в первичных реакциях приобретается настолько большая энергия, что повышение температуры может изменить ее лишь очень незначительно. [43]
Фотохимические реакции протекают при воздействии света на химическую систему. Свет может вызвать диссоциацию молекул на радикалы ( гемолитические реакции), ионизацию молекул с последующим превращением ионов, ион-радикалов и атомов с молекулами и друг с другом. [44]
Фотохимические реакции протекают под действием видимого или ультрафиолетового света. Поглощение квантов света активирует молекулы, вызывая их диссоциацию на атомы и радикалы или переводя их в возбужденное состояние. Вследствие этого продукты реакции могут накапливаться в концентрациях, превышающих термодинамические равновесные при данной температуре. Скорость фотохимических реакций не зависит или слабо вависит от температуры при условии, что продукты реакции образуются непосредственно из возбужденных частиц, а также если фотохимическая стадия является лимитирующей стадией процесса. [45]
Страницы: 1 2 3 4