Записанная реакция
Cтраница 1
Записанные реакции наиболее ярко демонстрируют обратимость гидриррвания-дегидрирования, составляющую существенную черту этих процессов. [1]
Записанные реакции наиболее ярко демонстрируют обратимость гидрирования-дегидрирования, составляющую существенную черту этих процессов. [2]
Записанные реакции наиболее ярко демонстрируют обратимость гидрирования-дегидрирования, составляющую характерную особенность этих процессов. [3]
Записанные реакции наиболее ярко демонстрируют обратимость гидрирования - дегидрирования, составляющую существенную черту этих процессов. [4]
Правильно записанная реакция является выражением закона сохранения. В результате химических реакций атомы не разрушаются и не образуются. Следовательно, в исходных веществах и в продуктах реакции должно быть одинаковое число одних и тех же атомов. В результате химических реакций также не происходит ни уничтожения, ни образования электрических зарядов. Следовательно, сумма зарядов исходных веществ должна быть равна сумме зарядов продуктов реакции. Правильную запись уравнения химической реакции с учетом этих законов сохранения называют уравниванием химической реакции. [5]
Вторая из записанных реакций слишком медленна, чтобы непосредственно влиять на скорость абсорбции. Подобная конструкция обусловлена необходимостью обеспечения достаточного времени для прохождения второй реакции. [6]
По-видимому, все записанные реакции являются сложными. [7]
Как видно из записанных реакций, при разложении бис - ( алкилксантогенатов) и этилен - ( бис-алкилксантогенатов) образуются и более простые соединения, среди которых активными по отношению к металлам являются сероводород, свободная сера, меркаптаны, диалкилсуль-фиды и ксантогеновая кислота. Эти продукты и реагируют с металлами, образуя сульфиды металлов. [8]
В переходном состоянии записанной реакции связь С - Н ослаблена сильнее, чем связь С-N, и промежуточный карбанион ( или близкое к нему по структуре переходное состояние) оказывается менее дестабилизированным алкильными группами при образовании менее разветвленного олефина. [9]
О - следовательно, записанная реакция протекает самопроизвольно в прямом направлении. Из этого следует, что в нормальных условиях кислород является более сильным окислителем, чем хлор. [10]
Дело в том, что записанная реакция отличается большим выходом, а бериллиевые пластины выдерживают очень интенсивную бомбардировку дейтронами. Интенсивность получаемого потока нейтронов зависит от энергии и количества дейтронов, бомбардирующих бериллиевую мишень, но во всяком случае интенсивность эта несравнимо выше, чем та, которую дает радиево-бериллиевый препарат, взятый даже в очень больших количествах. [11]
Получили отрицательную величину, что свидетельствует о возможности самопроизвольного протекания записанной реакции. [12]
Ионы S2 - образуют трудно растворимый осадок MnS, поэтому равновесие записанной реакции смещается вправо. [13]
В этих случаях значения Е положительны, что согласуется с практически полным протеканием записанных реакций слева направо. Хлор является хорошим окислителем ( высокое значение ПИ указывает на то, что он способен прочно удерживать и присоединять электроны); он действует быстро и сильно, эффективно отрывая электроны от атомов других элементов. Кислород - более дешевый окислитель, но он обычно действует медленнее и менее эффективен. Поэтому, когда подбирают окислитель, сначала пробуют применить кислород, так как его можно получить прямо из атмосферного воздуха и это обходится дешевле. Если же кислород оказывается недостаточно эффективным по причине медленного действия или неподходящих условий равновесия, приходится использовать в качестве окислителя хлор. Разумеется, существуют и другие окислители, используемые в процессах, где нельзя применить хлор. [14]
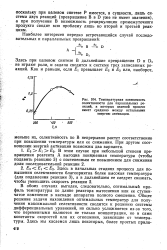 |
Температурная зависимость селективности для параллельных реакций, в которых целевой процесс имеет среднюю между остальными энергию активации. [15] |
Страницы: 1 2