Химическая реакция - окисление
Cтраница 2
Горение представляет собой химическую реакцию окисления горючего вещества, сопровождающуюся выделением большого количества тепла и, обычно, свечением. Окислителем, как правило, является кислород. [16]
Горение - это химическая реакция окисления, сопровождающаяся выделением большого количества тепла и обычно свечением. Окислителем в процессе горения может быть кислород, а также хлор, бром и другие вещества. [17]
Горение - это химическая реакция окисления вещества, сопровождающееся выделением теплоты и обычно свечением. [18]
Как указывалось, химическая реакция окисления углерода протекает гетерогенно на границе металла с пузырьком и тесно объединена с актом десорбции окиси углерода. Иначе говоря, растворенные в железе атомы углерода и кислорода только на поверхности раздела с пузырьком образуют молекулу СО, переходящую в газовую фазу. Этот поверхностный процесс требует одновременного присутствия на межфазной границе углерода и кислорода. Непосредственное взаимодействие частиц углерода с молекулой кислорода мало вероятно. Прочные связи атомов в последней должны быть предварительно сильно ослаблены. Это происходит при хемадсорбции кислорода на железе. В мартеновской печи этот процесс может лимитироваться несколькими стадиями: диффузией ионов Fe2 и Fe3 в шлаке, атомов О и С в металле, зарождением пузырьков СО и собственно химическими актами. [19]
Расчет констант скорости химической реакции окисления мер-каптидов натрия от продолжительности и способа окисления показывает, что степень вддкофазного акустического окисления по сравнению с механическим перемешиванием и каталитической регенерацией выше на три порядка в пять раз соответственна. [20]
Горение топлива представляет собой химическую реакцию окисления его составных частей с кислородом воздуха, сопровождающуюся значительным тепловым эффектом. [21]
Горение топлива представляет собой химическую реакцию окисления его горючих составных частей кислородом воздуха, в процессе которой выделяется значительное количество тепла. Для полного сгорания топлива необходимо создать условия, при которых реакция окисления будет происходить легко и быстро. [22]
Горение топлива представляет собой химическую реакцию окисления составных частей топлива, протекающую с известной скоростью и сопровождающуюся значительным выделением тепла и повышением температуры. [23]
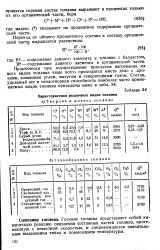 |
Характеристика различных видов топлива. [24] |
Горение топлива представляет собой химическую реакцию окисления составных частей топлива, протекающую с известной скоростью, и сопровождается значительным выделением тепла и повышением температуры. [25]
Каждой редоксо-цепи соответствует своя химическая реакция окисления - восстановления, которая возникает при взаимодействии двух различных равновесных систем типа ( VI 1.9), что можно осуществить, например, простым смешением содержимого обоих полуэлементов. Особенность состоит в том, что при взаимодействии окислителей и восстановителей в их смеси направленный поток электронов ( в виде электрического тока) не будет обнаруживаться - электрическая энергия редоксо-реакции переходит в тепловую. [26]
Для того чтобы прошла Химическая реакция окисления - восста - новления, необходимо присутствие атомов, молекул или ионов, взаимно противоположных по своей способности отдавать или присоединять электроны. Как уже говорилось, те из них, которые отдают электроны, являются восстановителями, а которые присоединяют - окислителями. [27]
Химическая коррозия является результатом химических реакций окисления металлов в газах, воде, а также в агрессивных органических веществах - неэлектролитах. [28]
Выделение тепла обусловлено протекающими химическими реакциями окисления углерода, водорода и серы, содержащихся в топливе как в свободном, так и в связанном состоянии. [29]
Горение - это быстро протекающая химическая реакция окисления горючего вещества кислородом воздуха или другим окислителем, при котором выделяется тепло и свет. Чтобы возникло и протекало горение, необходимо наличие горючего вещества, кислорода ( или другого реагента) и какого-либо источника тепловой энергии для воспламенения, который должен нагреть реагирующие вещества до необходимой температуры. [30]
Страницы: 1 2 3 4