Элементарная химическая реакция
Cтраница 1
Элементарные химические реакции классифицируются по способам разрыва и образования связей, зависящим от химической природы реагентов и среды, в которой происходит реакция. [1]
Элементарные химические реакции складываются из огромного числа элементарных актов химического превращения, каждый из которых можно рассматривать независимо от остальных элементарных актов, совершающихся в системе. Основными участниками элементарного акта являются частицы, претерпевающие химическое превращение. Рассмотрим реакцию водорода с хлором. [2]
Все гомогенные элементарные химические реакции различают по числу молекул, участвующих в элементарном акте химического взаимодействия. По этому признаку реакции разделяют на мономолекулярные, бимолекулярные и тримолекулярные. [3]
Продукт элементарной химической реакции оказывается носителем большого запаса энергии - теплоты реакции и энергии активации. В одних процессах эта энергия вызывает возбуждение конечных продуктов реакции и тогда большей частью быстро рассеивается в окружающем пространстве при соударениях молекул или путем излучения, что приводит к разогреву реагирующей среды. [4]
При каждой элементарной химической реакции в системе выполняется закон сохранения массы, хотя это может быть неочевидным после того, как концентрация каждого вещества, которая не зависит от времени, включена в выражение для константы скорости реакции. Однако полная масса смеси не обязательно будет постоянной, поскольку система является открытой и могут отсутствовать величины, сохраняющиеся в ходе реакции. [5]
О системе элементарных химических реакций, определяющих развитие процесса, в ряде случаев также пока еще существуют различные мнения. Так, например, при расчете неравновесного расширения в сопле продуктов сгорания водорода в воздухе в работе [5] рассматривается система из 14 реакций, в работе [6] учитывается восемь реакций, а в работе [7] принимается во внимание всего только шесть реакций. Автору известны лишь три исследования, в которых делается попытка оценить влияние принятой схемы протекания реакций и исходных величин констант скоростей на результаты расчета процесса рекомбинации в сопле газовой смеси Н - О - N. [6]
При протекании элементарной химической реакции исходные вещества переходят из основного энергетического состояния в возбужденное. Этот переход сопровождается изменением конфигурации реагирующих частиц и изменением потенциальной энергии состоящей из них системы реагирующих частиц. [7]
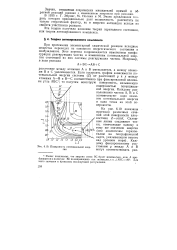 |
Поверхность потенциальной энергии. [8] |
При протекании элементарной химической реакции исходные вещества переходят из сановного энергетического состояния в возбужденное. Этот переход сопровождается изменением конфигурации реагирующих частиц и изменением потенциальной энергии состоящей из них системы реагирующих частиц. [9]
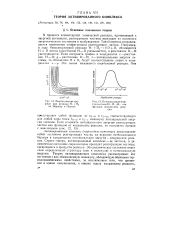 |
Энергетические профили для реакции Н-4 Нг по Эйрингу и Поляни. [10] |
В процессе элементарной химической реакции, протекающей с энергией активации, реагирующие частицы переходят из основного энергетического состояния в возбужденное. Такой переход сопровождается изменением конфигурации реагирующих частиц. Например, в ходе бимолекулярной реакции H - D2 - - HD D - сближаются Н и D атомы ( расстояние Н - D уменьшается), а расстояние D-D увеличивается. [11]
 |
Энергия активации Е и стерические факторы Р некоторых газофазных бимолекулярных реакций. [12] |
В процессе элементарной Химической реакции, протекающей с энер гией активации, реагирующие частицы переходят из основного энергетического состояния в возбужденное. Такой переход сопровождается изменением конфигурации реагирующих частиц. [13]
Исследование скорости элементарных химических реакций на основе корреляционного метода дает косвенную информацию о механизме реакции. Этот метод, будучи по сути феноменологическим, непригоден для расчета абсолютных скоростей реакций: экспериментальная кинетика приводит к корреляционным уравнениям, которые затем применяются для интерпретации нового кинетического опыта, причем наиболее надежные результаты, естественно, носят относительный характер. [14]
Среди многообразия элементарных химических реакций, известных в настоящее время, имеется большая группа процессов, идущих с образованием промежуточных комплексов. Подобные реакции протекают как в газовой, так и в конденсированной фазах, причем в различных случаях в понятие комплекса вкладывается различное содержание. Наиболее точно это понятие определено для газовых реакций, где под комплексом можно понимать любые молекулярные образования, существующие время, меньшее среднего времени между столкновениями, и поэтому не взаимодействующие с остальной системой. В конденсированных фазах в понятие комплекса необходимо включать, кроме собственно реагирующих частиц, и некоторую область ближайшего к ним окружения. Неопределенность последней и не позволяет ввести однозначного определения комплекса. [15]
Страницы: 1 2 3 4