Другая химическая реакция
Cтраница 2
Чем отличаются реакции окисления-восстановления от других химических реакций. [16]
Чем отличаются окислительно-восстановительные реакции от других химических реакций. [17]
Чем отличается реакция окисления-восстановления от других химических реакций. [18]
Хлорорганические растворители участвуют в ряде других химических реакций, кроме описанных выше. [19]
Чем отличаются окислительно-восстановительные реакции от других химических реакций. [20]
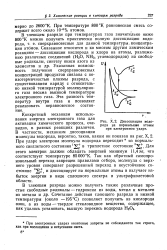 |
Диссоциация водорода на нормальные атомы при электронном ударе. [21] |
Сказанное относится и ко многим другим химическим реакциям - диссоциации кислорода и хлора на атомы, разложению различных соединений ( Н2О, МНз, углеводородов) на свободные радикалы, синтезу окиси азота из элементов и др. Указанная возможность получения сверхравновесных концентраций продуктов связана с не-изотермичностью плазмы разряда, с существованием наряду с относительно низкой температурой молекулярного газа весьма высокой температуры электронного газа. Эта разность температур внутри газа и позволяет реализовать неравновесное состояние. [22]
Эти реакции на электродах, подобно другим химическим реакциям, могут протекать через различные стадии; предшествующее описание анодной реакции не следует истолковывать таким образом, что оно дает точную последовательность протекающих процессов. [23]
Аналогичное явление наблюдается и при других химических реакциях. Таким образом, химические реакции - обратимы: наряду с химическим взаимодействием между исходными веществами ( прямая реакция) протекает химическое взаимодействие между продуктами реакции ( обратная реакция), в результате которого снова образуются исходные вещества. По мере протекания процесса скорость прямой реакции ( количество молекул продуктов реакции, образующихся в секунду) уменьшается, а скорость обратной реакции ( количество молекул этих продуктов, прореагировавших в секунду) увеличивается. Когда обе скорости сравняются, наступает состояние химического равновесия - число молекул веществ, составляющих химическую систему, перестает меняться и остается постоянным во времени при неизменных внешних условиях. Таким образом, химическое равновесие является динамичным и подвижным - с изменением внешних условий равновесие сдвигается в одну или в другую сторону и возвращается к исходному состоянию, если внешние условия достигают первоначальных значений. [24]
Аналогичное явление наблюдается и при других химических реакциях. Таким образом, химические реакции - обратимы: наряду с химическим взаимодействием между исходными веществами ( прямая реакция) протекает химическое взаимодействие между продуктами реакции ( обратная реакция), в результате которого-снова образуются исходные вещества. По мере протекания процесса скорость прямой реакции ( количество молекул продуктов реакции, образующихся в секунду) уменьшается, а скорость ебрат-ной реакции ( количество молекул этих продуктов, прореагировавших в секунду) увеличивается. Когда обе скорости сравняются, наступает состояние химического равновесия - число молекул веществ, составляющих химическую систему, перестает меняться и остается постоянным во времени при неизменных внешних условиях. Таким образом, химическое равновесие является динамичным и подвижным - с изменением внешних условий равновесие сдвигается в одну или в другую сторону и возвращается к исходному состоянию, если внешние условия достигают первоначальных значений. [25]
Аналогичное явление наблюдается и при других химических реакциях. Таким образом, химические реакции-обратимы: наряду с химическим взаимодействием между исходными веществами ( прямая реакция) протекает химическое взаимодействие между продуктами реакции ( обратная реакция), в результате которого снова образуются исходные вещества. По мере протекания процесса скорость прямой реакции ( количество молекул продуктов реакции, образующихся в секунду) уменьшается, а скорость обратной реакции ( количество молекул этих продуктов, прореагировавших в секунду) увеличивается. Когда обе скорости сравняются, наступает состояние химического равновесия-число молекул веществ, составляющих химическую систему, перестает меняться и остается постоянным во времени при неизменных внешних условиях. [26]
Ароматические полиамиды могут вступать и в другие химические реакции, механизм которых в настоящее время не установлен. Так, при термообработке ароматических полиамидов при высоких температурах, кроме описанных выше реакций концевых групп, происходит ряд других химических превращений, приводящих к повышению термостабильности изделий. Эти реакции используются для повышения негорючести изделий из ароматических полиамидов. [27]
Диссоциация, так же как и любая другая химическая реакция, характеризуется константой равновесия, называемой константой диссоциации, которая зависит от температуры раствора и типа растворителя. [28]
Снижение энергии активации характерно для многих других химических реакций, ускоряемых катализаторами. Запас энергии у молекул перекиси водорода должен достигнуть 16000 калорий, чтобы началась термическая реакция разложения. [29]
Константа поликонденсационного равновесия, как и любой другой химической реакции, зависит от температуры. На рис. 19 приведены данные, показывающие температурную зависимость константы равновесия реакции поли конденсации бис-2 - ( окси-этил) - терефталата. [30]
Страницы: 1 2 3 4