Поверхностная химическая реакция
Cтраница 2
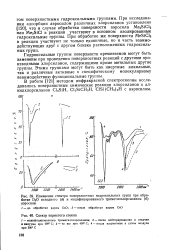 |
Изменение спектра поверхностных гидроксильных групп при обработке DjO исходного ( а и модифицированного триметилхлорсиланом ( б аэросила.| Спектр пористого стекла. [16] |
В работе [121] методом инфракрасной спектроскопии исследовались поверхностные химические реакции хлорсиланов и ал-килхлорсиланов Cl3SiH, CbSiCHsH, ClSi ( CH3) 2H с аэросилом. [17]
Теория поверхностных химических соединений Шилова рассматривает область поверхностных химических реакций как промежуточную между областью поглощения ( молекулярной сорбции) и областью обычной химической реакции. Согласно этой теории, поверхностные химические реакции, так же как и молекулярная сорбция, не приводят ни к каким новым веществам, которые можно было бы выделить, так как атомы твердого тела, вступая в поверхностную химическую реакцию, не порывают связи с другими атомами, составляющими пространственную решетку этого твердого тела. Поэтому поверхностные химические соединения и не выделяются в виде новой фазы. Поверхностные соединения нужно считать стехиометрически неопределенными и неопределенными также в отношении своего фазового состояния. [18]
Скорость окисления FeS для зерен флотационного колчедана лимитируется поверхностной химической реакцией. В рабочем диапазоне температура оказывает сравнительно слабое влияние на скорость процесса. [19]
Выражение ( 7 - 1) представляет собой скорость поверхностной химической реакции при высокотемпературном горении. [20]
 |
Влияние концентрации кислорода на противоизносные свойства бензола ( сплошные линии и циклогексана ( пунктирные линии. [21] |
Для ответа на эти вопросы и для дальнейшего исследования поверхностных химических реакций было изучено трение в присутствии бензола и циклогексана при различных концентрациях кислорода. Эти вещества выбрали в качестве модельных систем потому, что они представляют собой простейшую пару сравнимых между собой углеводородов ароматического и нафтенового рядов. Кроме того, летучесть этих соединений облегчает не только возможность изменения концентрации в них кислорода, но и отделение продуктов износа. [22]
Предельный для процессов рекомбинации случай, когда константа скорости поверхностной химической реакции равна бесконечности, обычно называют случаем с идеальной каталитической стенкой. [23]
Адсорбция ряда веществ на силикагеле необратима и часто сопровождается поверхностной химической реакцией. При этом наблюдается отравление поверхности, проявляющееся в уменьшении адсорбционной способности и теплоты адсорбции. Регенерация достигается обработкой водяным паром. Ей соответствуют четыре структурных типа: кварц - непористый и высокодисперсный, силикагель: - однородно крупнопористый, силикагель-однородно мелкопористый и силикагель, имеющий смешанные поры. [24]
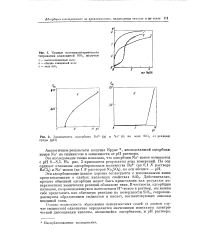 |
Кривые потенциометрического титрования коллоидной SiO2 щелочью.| Зависимость адсорбции Ва2 ( а и Na ( б на золе Si02 от реакции среды ( рН. [25] |
Действительно, процесс обменной адсорбции может быть представлен как результат поверхностных химических реакций обменного типа. [26]
В этом случае все стадии, за исключением связанных с поверхностной химической реакцией, быстрые, поэтому для каждого из веществ А, В и С устанавливается адсорбционно-десорбционное равновесие. [27]
Наиболее важными, типичными стадиями рассматриваемых процессов являются адсорбция реагентов, поверхностная химическая реакция, десорбция продуктов. Задача состоит в том, чтобы скорость реакции W выразить как функцию экспериментально измеряемых концентраций С. Для этого необходимо знать характер зависимости BL / ( С. [28]
Наиболее важными, типичными стадиаш рассматриваемых процессов являются адсорбция реагентов, поверхностная химическая реакция, десорбция ПРОДУКТОВ. Скорость этих стадий зависит от поверхностных концентраций реагентов ( степеней заполнения поверхности 8t), которые недоступна непосредственному определению в обычных кинетических экспериментах. Задача состоит в том, чтобы скорость реакции / f выразить как функцию экспериментально измеряемых концентраций С. [29]
Рассмотрим случай, корда имеется единственное поверхностно-активное вещество, участвующее в поверхностной химической реакции. Объемные и поверхностные концентрации других веществ фиксированы. [30]
Страницы: 1 2 3 4