Значение - ионное произведение - вода
Cтраница 1
Значение ионного произведения воды Л н2О увеличивается с температурой. [1]
Как изменяется значение ионного произведения воды с повышением температуры. [2]
При увеличении температуры значение ионного произведения воды возрастает. [3]
Строго говоря, значение ионного произведения воды могло бы считаться независимым от состава раствора лишь при выводе его на основе не концентраций, а активностей. [4]
Строго говоря, значение ионного произведения воды могло бы считаться независимым от состава раствора лишь при выводе его на основе не концентраций, а активностей. [5]
При увеличении температуры значение ионного произведения воды возрастает. [6]
При увеличении температуры значение ионного произведения воды возрастает. [7]
Аналогично могут быть вычислены значения ионного произведения воды при других температурах. [8]
Для kw должно быть подставлено значение ионного произведения воды при температуре опыта и применяемой ионной силе. [9]
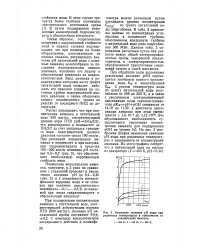 |
Изменение значения рН воды при. [10] |
При обработке воды щелочными реагентами значение рОН определяется значением ионного произведения воды Kvf и концентрацией Сон - С ростом температуры воды по тракту питательной воды энергоблока от 298 до 523 К, и в связи с увеличением электролитической диссоциации воды значение показателя pKwpH pOH снижается от 14 10 до 11 22, а константа диссоциации аммиака при этом уменьшается с 1 8 - Ю-5 до 1 12 - КН. На рис. 3 изображен график изменения значения рН воды при различных температурах в зависимости от концентрации аммиака. [11]
Величину Kw называют ионным произведением воды. Для данной температуры она является постоянной, как для самой воды, так и для ее разбавленных растворов. Так как с изменением температуры меняется значение Кл воды, то соответственно меняется и значение ионного произведения воды Kw, а также и концентрация Н - и ОН - - ионов, но при этом в самой воде концентрация Н - ИОНОБ равна концентрации ОН-ионов. Как бы не менялись концентрации Н - и ОН - - ионов, произведение их для любого водного раствора представляет собой величину постоянную при данной температуре. При повышении температуры / Сш возрастает. [12]
Амфотерные соединения являются слабыми электролитами. Это следует из того, что амфотерность выражает две противоположные тенденции в структуре молекулы. Другим фактором, который делает невозможным одновременное проявление далеко продвинутых кислотной и основной диссоциаций, является значение ионного произведения воды. Оно не может быть превзойдено, но это произошло бы, если бы гидроокись одновременно в значительной степени диссоциировала как кислота и как основание. [13]
Энергия образования молекулы воды высока и составляет 242 кДж / моль, поэтому вода химически весьма устойчива, особенно в природных условиях. Эта устойчивость в сочетании с электрическими характеристиками воды и молекулярным строением делает воду практически универсальным растворителем для многих веществ. Большинство минеральных и органических веществ, а также газов растворимы в воде. Значение ионного произведения воды ( Н) ( ОН) Л в составляет 10 - 14 ( моль / л) 2 при 23 С. [14]
Страницы: 1