Редкоземельные
Cтраница 1
Редкоземельные элементы обладают очень сходными химическими свойствами, их валентность равна трем. По-видимому, все эти элементы необходимо было поместить в один столбец периодической таблицы. [1]
Редкоземельные элементы при этом не сооса-ждаются. [2]
Редкоземельные элементы в свою очередь подразделяются на цериевые ( La, Се, Рг, Nd, Pm, Sm, Eu) и иттриевые ( Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu, Y) элементы. [3]
Редкоземельные элементы заметно различаются давлением пара при температуре плавления. По уменьшению летучести металлы располагаются в ряд: Eu Yb Sm Lu Tu Но Dy Er Gd. [4]
Редкоземельные металлы и иттрий химически активны: во влажном воздухе тускнеют, покрываясь пленкой окисла. При нагревании в атмосфере кислорода лантаноиды загораются, образуя окислы. Разлагают холодную воду несколько медленнее, чем горячую, вытесняя водород. Сродство к кислороду понижается с возрастанием порядкового номера. Растворяются в серной и соляной кислотах любой концентрации, а также в концентрированной азотной кислоте. Щелочи на них не действуют даже при нагревании. С галогенами взаимодействуют при сравнительно невысокой температуре; интенсивность взаимодействия уменьшается от фтора к иоду. При сплавлении с серой, теллуром, селеном образуют сульфиды, теллуриды, селениды. [5]
Редкоземельные металлы взаимодействуют с водородом медленно при комнатной температуре, быстрее при более высокой температуре ( 250 - 300), иттрий-при 400 в вакууме. Образуются красно-коричневый гидрид церия, черный гидрид лантана, блестящие, аморфные, индиго-синие гидриды неодима и празеодима, хрупкий сине-серый гидрид иттрия YHj. [6]
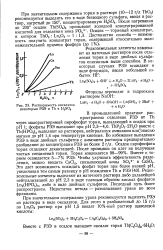 |
Растворимость оксалатов -. [7] |
Редкоземельные элементы извлекают из маточных растворов после отделения тория в виде двойных сульфатов описанным выше способом. [8]
Редкоземельные элементы обычно восстанавливаются в очень отрицательной области потенциалов, и потому метод расчета констант нестойкости по сдвигу потенциалов полуволн к ним неприменим. [9]
Редкоземельные элементы образуют особую группу. [10]
Редкоземельные металлы в основном получают электролизом безводных хлоридов или фторидов, а также металлотермическим методом. Для получения лантаноидов высокой чистоты используют металлотермический метод. [11]
Редкоземельные металлы обладают заметным различием в давлении пара при температуре их плавления. [12]
Редкоземельные металлы обладают большой химической активностью. Во влажном воздухе тускнеют, покрываясь пленкой окисла, и приобретают окраску, соответствующую окислам отдельных элементов - Элементы иттриевой подгруппы значительно устойчивее на воздухе, чем элементы цериевой подгруппы. [13]
Редкоземельные элементы образуют соли и с другими органическими кислотами. Формиаты легких РЗЭ кристаллизуются при обыкновенной температуре из водных растворов без кристаллизационной воды, тогда как формиаты тяжелых РЗЭ кристаллизуются с различным содержанием кристаллизационной воды, а при температуре кипения выделяются безводными, которые трудно растворимы в воде. [14]
Редкоземельные металлы взаимодействуют с водородом медленно при комнатной температуре, быстрее - при более высоких температурах ( 250 - 300) При этом образуются гидрид церия в виде красно-коричневой массы, гидрид лантана в виде черной массы, гидриды неодима и празеодима в виде блестящей аморфной индиго-синей массы. [15]
Страницы: 1 2 3 4