Редокс-потенциал - система
Cтраница 1
Редокс-потенциал системы в кислой среде равен 0 68 В. Концентрацию устанавливают титрованием раствором бихромата калия в присутствии дифениламина. Нейтральные растворы гидрохинона нестабильны, щелочные растворы разлагаются и темнеют, однако растворы в 1 - 3 % - ной серной или соляной кислоте сохраняют концентрацию в течение нескольких месяцев. [1]
Величина редокс-потенциала системы характеризует ее окислительно-восстановительную способность. [2]
Сначала рассчитывается редокс-потенциал системы ацетон - изопропанол, так как эта система совершенно неспособна вызывать определенный потенциал на индикаторном электроде. [3]
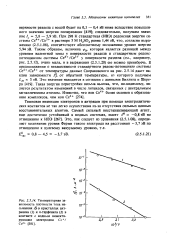 |
Температурная зависимость плотности тока насыщения J % в кристаллах антрацена ( 1 я / г-терфенила ( 2 в контакте с водным инжектирующим электродом Се / Се34 -. [4] |
В предположении о независимости стандартного редокс-потенциала системы Се4 / Се3 от температуры данные Свораковского на рис. 2 5.14 дают наклон зависимости J p от обратной температуры, и. Такая энергия перестройки весьма высока, что, по-видимому, является результатом изменений в числе лигандов, связанных с центральным металлическим атомом. [5]
 |
Кинетика накопления активного хлора в процессе электролиза растворов NaCl ( 2 г / л с красителями ПЧГ ( / - 3, 5 и КЯСА ( 4. [6] |
В этом случае с целью увеличения степени минерализации остаточных продуктов электрохимической деструкции необходимо применение других, качественно новых, решений, способствующих повышению редокс-потенциала системы. [7]
Комплексы уранила более растворимы. Это дает возможность использовать редокс-потенциал системы U4 / U6 для потенциометрического определения фтора. Если растворы наряду с фторидами содержат небольшое количество ионов UC22, то при титровании их солями U4 вначале наблюдается повышенная способность к окислению. Вводимые при титровании ионы U4 связываются вследствие образования MeUFs. При достижении эквивалентной точки, соответствующей образованию указанного комплекса, из-за избытка ионов U4 создаются восстановительные условия, что в свою очередь связано со скачком потенциала. С другой стороны, редокс-потенциал зависит от концентрации водородных ионов, что требует поддержания постоянного значения рН при титровании. [8]
Комплексы уранила более растворимы. Это дает возможность использовать редокс-потенциал системы U4 / U6 для потенциометрического определения фтора. При достижении эквивалентной точки, соответствующей образованию указанного комплекса, из-за избытка ионов U4 создаются восстановительные условия, что в свою очередь связано со скачком потенциала. С другой стороны, редокс-потенциал зависит от концентрации водородных ионов, что требует поддержания постоянного значения рН при титровании. [9]
Характерное отличие рассмотренных кривых от кривых титрования, приведенных в других разделах этой главы, состоит в том, что их участок эквивалентности не зависит от разбавления, а только от соотношения абсолютных количеств присутствующих компонентов. Например, разбавление раствора, содержащего определенные количества Fe3 и Fe2, не меняет редокс-потенциала системы, поскольку объем раствора, который входит в числитель и знаменатель уравнения ( X. Однако, если 1 моль одного компонента редокс-пары в результате соответствующей полуреакции дает 2 моль или больше второго компонента, то тогда соответствующие концентрации, а, следовательно, и объем раствора, входят в логарифмический член уравнения Нернста в разной степени, изменяя числитель и знаменатель, и разбавление скажется на значении редокс-потенциала. [10]
При полярографических исследованиях органических систем окисленные формы часто восстанавливаются обратимо с образованием промежуточного радикала, который затем димеризуется необратимо. В этих случаях волна имеет форму, свойственную обратимым процессам, но потенциал полуволны отличается от нормального редокс-потенциала системы. [11]
Эффективность действия переносчика определяется высокими скоростями всех стадий процесса и близостью термодинамического редокс-потенци-ала системы Ег-Bz - или В-ВНП к редокс-потенциалу системы АН - А. [13]
Уравнение Нернста показывает, что потенциал редокс-системы зависит от активностей ее участников. Если ка кие-то компоненты системы могут участвовать в протоли-тическом равновесии, то изменение рН среды сопровождается и изменением активностей, что влияет на значения редокс-потенциала системы. Еще более непосредственно влияет изменение протонной активности на редокс-реакции, в которых прямо участвуют протоны или ионы гидроксила. Изменения рН могут так существенно менять редокс-потенциалы некоторых участников, что может изменяться даже направление реакции. [14]
Уже указывалось, что химическая реакция, в которую вступают продукты обратимой электрохимической реакции, вызывает смещение потенциала от величины, характерной для данной редокс-системы. Величина сдвига между Eij2 и Е тем больше, чем выше скорость реакции, в которую вступает электродный продукт, и чем больше период капания электрода, при этом по величине этого сдвига, если известен нормальный редокс-потенциал системы Е, по уравнениям, выведенным Коутецким [24] или Керном [25], может быть найдена константа скорости последующей химической реакции. [15]
Страницы: 1 2
