Значение - энергия - стабилизация
Cтраница 1
Значения энергии стабилизации пзяты Из следующих нсточинков: расчеты по методу МОХ [ 69 а, МОХ модиф. [1]
Значения энергии стабилизации, вычисленные по методу молекулярных орби-талей [23] для комплексов 19а или 6а, ЗЗа или 62а и для ЗЗе ( разд. III), а также расчеты по методу Миллера для комплексов 19а, ЗЗа ( рис. 13) и 50з [25] подтверждаются такой последовательностью стабильности комплексов. Наибольшее влияние на стабилизацию комплекса оказывает и-нитрогруппа. [2]
Полученные таким образом значения энергии стабилизации можно использовать для решения различных термодинамических и кинетических задач. В качестве примера задач первого типа приведем определение теплоты гидратации ионов переходных элементов; задачи второго типа рассматриваются в следующей главе. [3]
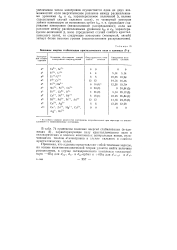 |
Величины энергии стабилизации кристаллического поля в единицах D q. [4] |
В табл. 74 приведены значения энергий стабилизации ( в единицах А), характеризующие силу кристаллического поля в октаэдрических и плоских комплексах центральных ионов, отличающихся числом rf - электронов в случае сильного и слабого кристаллических полей. [5]
ЭД могут существенно отличаться от значений энергии стабилизации, вычисленных исходя из экспериментальных данных. [6]
Бейсоло и Пирсон [ 26а ] рассмотрели недавно значения энергий стабилизации в кристаллическом поле для разных стереохимических изменений при диссоциации. Однако пока неизвестна степень влияния растворителя. Различие между [ AuCI4 - и [ PtCl4P - не может быть сведено только к различию в зарядах ( см. ниже), и [ AuClJ заслуживает дальнейшего исследования. [7]
В табл. 11.5 показано распределение электронов для ионов ] ( d - d10), образующих октаэдрические комплексы, и приведены значения энергии стабилизации кристаллическим полем ( ЭСКП) для каждой из них - выигрыш в энергии за счет размещения большинства электронов на / 28-орбиталях. [8]
Очевидно, что последовательность ионов, расположенных по возрастающим значениям Р ( v), не идентична последовательности, построенной в соответствии со значениями энергий стабилизации. Как вытекает из табл. 2.15, в которой проведено сопоставление с экспериментальными данными, значения степени обращенности шпинели, найденные на основании данных об энергии Р ( v), более близки к действительности. [9]
Так же рак и в оьтаэдричесьом поле, рля некоторых ионов ( № -, d - ионы) истинные значения чисел заполнения п, пе не равны целым числам, поэтому приведенные конфигурации и значения энергии стабилизации являются для них лишь приблизительными. [10]
Бутадиен-1 3 3 5 ккал; пентадиен-1 3 6 5 ккал; пентадиен-1 4 - 0 2 ккал; циклогексадиен-1 3 1 8 ккал и стирол 38 6 ккал. Значения энергии стабилизации, определенные из теплот сгорания, обычно менее надежны, чем те же данные, полученные из теплот гидрирования. Причина этого состоит в том, что они вычисляются по разности между двумя очень большими значениями, и, кроме того, рассчитанную теплоту сгорания находят из набора значений энергий связи, в какой-то степени условного. [11]
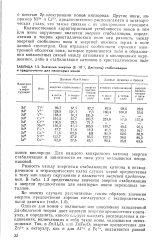 |
Значения энергии (. 10 - 3, Дж / моль стабилизации и предпочтения для некоторых ионов. [12] |
Разность между энергиями стабилизации катиона в октаэд-рическом и тетраэдрическом узлах служит мерой предпочтения к тому или иному окружению и называется энергией предпочтения. В табл. 1.3 представлены значения энергии стабилизации и энергии предпочтения для некоторых ионов переходных металлов. [13]
Интересно отметить, что энергия напряжения бензола по отношению к бутену-1 отрицательна и равна - 33 0 ккал / моль. Это очень близко к значению энергии стабилизации или резонанса бензола, равной 36 0 ккал / моль, которую можно вычислить, исходя из теплоты гидрирования циклогексена. [14]
В случае слабого кристаллического поля А меньше, чем энергия, необходимая для спаривания электронов на d - орби-талях; каждая из d - орбиталей будет занята единственным электроном, и спаривания не произойдет. С другой стороны, если А больше, чем энергия спаривания, то электроны будут спариваться на нижних орбиталях, до того как будут заселяться более высокие орбитали. Главными факторами, определяющими значение А, являются природа лиганда и заряд иона металла. В табл. 7 приведены значения энергии стабилизации кристаллическим полем для тетраэдрических и октаэдрических комплексов со слабым и сильным полем лигандов. Следует отметить, что в тетраэдрических комплексах спины и энергии отличаются в этих двух случаях только при наличии трех, четырех, пяти или шести d - элек-тронов. Подобным же образом в октаэдрических комплексах разграничение может быть сделано только для четырех, пяти, шести или семи d - электронов. [15]
Страницы: 1