Значение - энергия - активация - диффузия
Cтраница 2
Так, по данным многих авторов, значения энергии активации Q для интервала II скоростей деформации близки к значениям энергии активации граничной диффузии, а для интервала III - объемной диффузии. [16]
Значение Q процессов разупрочнения колеблются в зависимости от того, с протеканием каких элементарных процессов это связано: от значений энергии активации диффузии вакансий до энергии активации процессов граничной и объемной диффузии. [17]
Так как радиусы атомов Si, В, С и N составляют соответственно 1 18; 0 91; 0 77; 0 71 А, то следовало ожидать, что значения энергий активации диффузии для крупных атомов кремния и бора будут большими, чем для атомов углерода и азота. Однако экспериментально обнаруживается обратная картина ( рис. 4), которая, с известным приближением, может быть объяснена, исходя из рассмотрения механизма диффузионного процесса. [18]
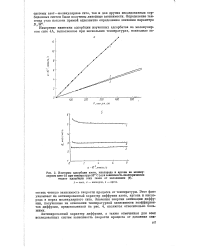 |
Изотермы адсорбции азота, кислорода и аргона на молекулярном сите 4А при температуре 35 С ( а и зависимость изостерических теплот адсорбции этих газов от заполнения ( б. [19] |
Этот факт указывает на активированный характер диффузии азота, аргона и кислорода в порах молекулярного сита. Значения энергии активации диффузии, полученные на основании температурной зависимости коэффициентов диффузии, представленной на рис. 4, являются относительно большими. [20]
Коэффициент пропорциональности, называемый коэффициентом диффузии, определяет кинетику процесса. Наиболее полное представление о закономерностях процесса диффузии может быть получено по значениям коэффициента диффузии, зависимости коэффициента диффузии от температуры, значениям энергии активации диффузии. [21]
 |
Влияние напряжения на распределение пор по зерну после отжига латуни при 600 С в течение 5 ч. [22] |
Были получены значения, которые находились в соответствии со значениями коэффициента диффузии цинка и магния в алюминии, а энергия активации процесса порообразования для сплава В-92 оказалась близкой к значениям энергии активации диффузии цинка в алюминии: 111 и 109 - 117 кдж / г-атом ( 26 4 и 26 - 28 ккал / г-атом) соответственно, получаемых независимо в диффузионных опытах. [23]
Было высказано мнение [33], что кинетика протонного обмена в подобных системах определяется кооперативным переносом протона в промежуточном комплексе. Для протонного обмена между спиртами, аминами и водой, который, по-видимому, тоже характеризуется кооперативным механизмом, константы скорости k значительно больше, а энергии активации ЛЕ близки к значению энергии активации диффузии. На основании изучения кинетического изотопного эффекта в системе метанол - вода в СС14 Бурейко и др. [12] пришли к выводу, что скорость протонного обмена определяется стадией образования циклического комплекса. Этот процесс может протекать очень медленно из-за чрезвычайно низкого значения константы равновесия. Хотя в этом случае скорость реакции не лимитируется диффузией, энергия активации может действительно определяться диффузией. Проблему лимитирующей стадии в различных механизмах процессов протонного обмена еще предстоит исследовать в дальнейшем. [24]
Рентгенострук-турный анализ показал, что в процессе нанесения меди на цинк и при последующем отжиге в данной системе не образуется интерметаллических соединений, которые могли бы существенно влиять на протекание диффузии и на ее параметры. Контрольные опыты показали также, что испарение с торцов образца пренебрежимо мало. Совпадение в пределах погрешности измерений значений энергии активации диффузии Q для разных температур отжига указывает на то, что предпосылки, положенные в основу расчета, верны. [25]
Страницы: 1 2