Значение - энтальпие
Cтраница 2
Значения энтальпий котловой воды и отсепарированных оды и пара взяты по таблицам насыщенного пара ( см. прилож. [16]
Значения энтальпий испарения AHevap чистых компонентов берутся из справочных данных, а избыточные теплоты смешения рассчитываются по данным об ассоциативном состоянии компонентов в растворе, например, методом ЯМР. [17]
Первые хроматографические значения энтальпий водородных связей кислота-основание методом ГЖХ были получены 52 по температурной зависимости величин удерживания кислоты в образующем Н - связи основании и в инертном растворителе, где Н - связи не образуются. Он основан на специальных предположениях о характере взаимодействия молекул и не распространяется на процессы комплексообразования за счет иных сил. Напротив, изучение Н - комплексов методом жидкой фазы переменного состава, в принципе, аналогично исследованию любых процессов комплексообразования хромато-графируемого вещества с добавляемым в неподвижную жидкость комплексообразователем. Это следует из того, что связь величин удерживания с, константами устойчивости комплексов и составом неподРшиций фазы-сгпределяется стехиометрией реакции, независимо от природы сил комплексообразования. [18]
Здесь значения энтальпий следует брать в ctoe / кг. [19]
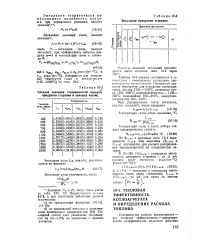 |
Энтальпии продуктов сгорания. [20] |
Расчеты значений энтальпий рекомендуется вести согласно табл. 10 - 4 через 100 С. [21]
 |
Конформацни и величины энтальпии днметилцнклогексанов. [22] |
Разность значений энтальпий цис - к троис-изо. [23]
Выбор значений энтальпий образования атомов в настоящее время существенно облегчен тем, что в справочниках [ 1 2 - 11, и 13 ] проведен тщательный анализ соответствующей литературы и выполнена обработка экспериментальных данных. Поэтому приводимые в табл. 4 величины в значительной мере основаны на рекомендациях этих изданий, дополненных в случае необходимости новыми экспериментальными данными. [24]
Расчет значений энтальпий растворения жидкого церия в жидком железе для различных концентраций раствора приведен в табл. VII-7. В этой же таблице определены значения вспомогательных функций М для процесса растворения жидкого церия в расплавленном железе при тех же концентрациях раствора и функций M [ Cev / a для твердого цбрия, растворенного в жидком железе. [25]
Тейлора значений энтальпий паровых и жидких потоков в окрестности точки Гзначительно ( в 2 - 3 раза) сокращает время расчета сложных разделительных систем. [26]
Как изменяются значения энтальпий плавления и возгонки, температур плавления и кипения, плотности металлов в ряду V - Nb - Та и чем это объясняется. [27]
Подстановка этих значений энтальпий в систему нелинейных уравнений общего теплового баланса (3.5) превращает ее в систему линейных уравнений. [28]
Подстановка этих значений энтальпий в систему нелинейных уравнений общего теплового баланса превращает ее в систему линейных уравнений. [29]
Для определения значений энтальпий ЛЯ смешения жидкостей обычно применяют калориметрический метод, который позволяет в прямом опыте получить данные высокой точности. В некоторых случаях энтальпии смешения определяют расчетным путем на основании температурной зависимости коэффициентов активности компонентов раствора. Для растворов неэлектролитов такой путь целесообразен в тех случаях, когда для системы имеются надежные политермические данные о равновесии жидкость-пар. В результате расчета может иметь место существенная ошибка в значениях энтальпий смешения, однако практически во всех случаях удается правильно определить порядок величины и знак ДЯ, а также характер зависимости АЯ от состава раствора. [30]
Страницы: 1 2 3 4