Значение - стандартное энтальпие
Cтраница 1
Значения стандартных энтальпий приведенных в таблице реакций диссоциации выражены в кДж моль-1. Предполагается, что все вещества представляют собой идеальные газы и находятся в основных ( невозбужденных) электронных состояниях при температуре 298 15 К. [1]
Значения стандартных энтальпий образования соединений приводятся в справочной литературе. [2]
Значения стандартных энтальпий образования веществ ДЯв при 298 15 К приведены в табл. 2 Приложения. [3]
Используя значения стандартных энтальпий образования соединений [6], энтальпий образования растворов азотной кислоты [7] и данные табл. 2, нетрудно рассчитать тепловые эффекты реакции ( 3) для заданных концентраций азотной кислоты. [4]
Из значений стандартных энтальпий образования тетрафторида кремния ( - 374 ккал / моль), серного ангидрида ( - 104 6 ккал / моль) и сульфида алюминия ( - 172 9 ккал / моль) следует, что все три веше. [5]
Последняя графа содержит значения стандартных энтальпий образования соединений ( в газообразном состоянии) ив простых веществ. [6]
В табл. 7 приведены значения стандартных энтальпий и энергий Гиббса образования некоторых веществ при 25 С ( 298 К) - Более полные данные этого рода можно найти в справочниках, например, в Кратком справочнике физтгко-хттмических величин под редакцией К. [7]
В табл. 6 приведены значения стандартных энтальпий образования радикалов и некоторых газообразных молекул неорганических веществ. [8]
В табл. 4 приведены значения стандартных энтальпий образования одноатомных газов из элементов в стандартных состояниях. В таблицу включены все элементы, вплоть до 96-го элемента периодической таблицы, хотя для некоторых тяжелых элементов данные об их энтальпиях сублимации и, следовательно, об энтальпиях образования соответствующих одноатомных газов отсутствуют. [9]
В табл. 5 приведены значения стандартных энтальпий образования радикалов органических веществ в газообразном состоянии. В качестве органических веществ в настоящей таблице ( так же, как и в табл. 2) принимались соединения, содержащие углерод, кислород, водород, галогены, серу, азот. [10]
Температуры плавления и кипения, значения длин связей и углов между связями для некоторых хлоридов приведены в табл. 7.6. Значения стандартных энтальпий указаны в приложении VI. Устойчивость соединений определяется разностью электроотрицательностей связанных между собой атомов с внесением соответствующих поправок для соединений азота и кислорода. [11]
Так как в рассмотренном примере произвольно были выбраны давление и температура, принятые нами ранее в качестве стандартных ( р 0 1 МПа; Т 298 К), то найденное значение абсолютной энтропии называется стандартной абсолютной энтропией и обозначается символом S2 § 8 - Такие вычисления проведены для очень многих веществ, и найденные значения помещены в те же таблицы, в которых были собраны значения стандартных энтальпий образования АЯ2) 8, стандартных энергий Гиббса образования ДС2э 8 и коэффициентов, входящих в выражения для теплоемкостей. [12]
Если энтальпии образования определяют при давлении 1 атм и при температуре 298 К, то их называют стандартными энтальпиями образования. Значения стандартных энтальпий образования содержатся в таблицах и могут быть найдены через энтальпии образования при других температурах. По стандартным энтальпиям образования могут быть найдены энтальпии реакций горения. [13]
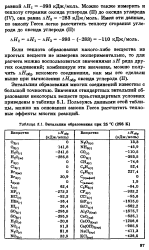 |
Энтальпии образованна при 25 С ( 298 К. [14] |
Энтальпии образования многих соединений известны с большой точностью. Значения стандартных энтальпий образования некоторых веществ при стандартных условиях приведены в таблице 5.1. Пользуясь данными этой таблицы, можно на основании закона Гесса рассчитать тепловые эффекты многих реакций. [15]
Страницы: 1 2