Значение - активность - вода
Cтраница 1
Значения активности воды в растворах NaHCOa вычисляются по более сложным формулам ( см. с. [1]
Выбрав какое-либо значение активности воды, вычисляют сумму, стоящую в левой части выражения. Если она не равна единице, задаются новым значением активности воды. [2]
В табл. 11.12 приведены значения активности воды в растворах с различной концентрацией сульфата натрия. [3]
Предложены методы термодинамического расчета значений активности воды и коэффициентов активности в области сверх-пересыщенных растворов на основе уравнения Гиббса - Дюгема и данных о совместной растворимости двух электролитов с общим ионом. Рассмотрено влияние индивидуальности второго электролита на результаты расчета. [4]
Экспериментальные данные, относящиеся к одному из значений активности воды ( аш 0 8426), представлены на рис. 1.10 и рис. 1.11, где показана зависимость величины 2 т и 2 Iя ш - ci и x ci соответственно при постоянной активности воды aw в системе. [5]
Практически расчеты свойств смешанных раство-ров производят с помощью таблиц значений активности воды а бинарных растворов электролитов в зависимости от концентрации раствора и температуры. [6]
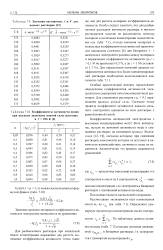 |
Значения постоянных А и В для водных растворов [ 12.| Коэффициенты активности ионов. [7] |
Коэффициенты активностей электролитов с высокими концентрациями могут быть вычислены, исходя из значений активности воды в смешанных растворах на основании правила Зданов-ского [12, 19], согласно которому при смешении растворов, компоненты которых не вступают в химическое взаимодействие, активность воды не изменяется. [8]
Исследована аддитивность значений обратных концентраций 1 / тга для одного и того же значения активности воды в четверных водных взаимных системах. Показано, что аддитивность имеет место в тех случаях, когда электролиты имеют одинаковую химическую природу. [9]
Порядок гидратации для катионов щелочных и щелочноземельных металлов следующий: Li XH30) Na K NH Rb Cs и Mg2 Са2 Sr2 Ba2, о чем можно судить ло значениям активности воды и предельной эквивалентной электропроводности ионов, например, в водных растворах галогенидов [65, 71], и именно в этих рядах увеличивается высаливающая способность электролитов в системах без химического взаимодействия между компонентами водной фа зы. [10]
В табл. 2 приведены данные об активности воды в насыщенных растворах электролитов при 25 С, а в табл. 3 - данные о концентра - ции изопиестических растворов при 25 С для различных округленных, равноотстоящих друг от друга значений активности воды. [11]
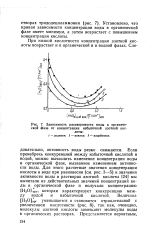 |
Зависимость растворимости воды в органической фазе от концентрации избыточной азотной кислоты. [12] |
Если пренебречь конкуренцией между избыточной кислотой и водой, можно вычислить изменение концентрации воды в органической фазе, вызванное изменением активности воды. Для этого расчетные значения концентрации кислоты в воде при равновесии ( см. рис. 3 - 5) и значения активности воды в растворах азотной кислоты [24] мы вычитали из действительных значений концентраций воды в органической фазе и получали концентрацию [ ЬЬО ] орг, которая характеризует конкуренцию между водой и избыточной кислотой. Величина [ Н2О ] орг уменьшается и становится отрицательной с увеличением кислотности ( рис. 8), так как, очевидно, молекулы азотной кислоты замещают молекулы воды в органических растворах. [13]
Страницы: 1