Результат - термохимическое измерение
Cтраница 1
Результаты термохимических измерений - тепловые эффекты реакций - принято относить к одному молю образующегося вещества. Количество теплоты, которое выделяется при образовании одного моля соединения из простых веществ, называется теплотой образования данного соединения. [1]
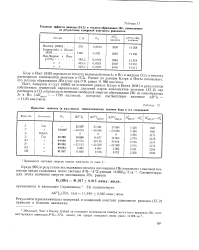 |
Принятые значения ( в кал / моль термохимических величин йода и его соединений. [2] |
Результаты термохимических измерений и измерений констант равновесия реакции (XI.2) приводят к близким значениям. [3]
Результаты термохимических измерений - тепловые эффекты реакций - принято относить к одному молю образующегося вещества. Количество теплоты, которое выделяется при образовании одного моля соединения из простых веществ, называется теплотой образования данного соединения. [4]
Результаты термохимических измерений - тепловые эффекты реакций принято относить к одному молю образующегося вещества. Количество теплоты, которое выделяется при образовании одного моля соединения из простых веществ, называется теплотой образования данного соединения. [5]
Результаты термохимических измерений - тепловые эффекты реакций - принято относить к одному молю образующегося вещества. Количество теплоты, которое выделяется при образовании одного моля соединения из простых веществ, называется теплотой образования данного соединения. [6]
Этот результат термохимических измерений Бертло Энгельс приводит по книге А. Наумана Руководство по общей и физической химии, Гейдельберг, 1877, стр. [7]
Этот результат термохимических измерений Бертло Энгельс приводит по книге А. [8]
Рассмотрим результаты недавних термохимических измерений, выполненных в нашей лаборатории. На рис. 1 показаны кривые зависимости температуры от концентрации кислот в безводном ТБФ. [9]
В результате термохимических измерений, проведенных с тщательно очищенными образцами лактонов III и VI, найдено, что энтропия формы кресло-ванна III на 5 3 ккал / моль выше, чем формы кресло - кресло VI. Модель лактона III показывает, что кольцо в этом соединении имеет форму несколько искаженной правильной ванны. Измерение взаимно не сокращающихся взаимодействий для двух лактонов ( табл. 7) приводит к энергетическому различию в 4 7 ккал / моль, что не слишком отличается от экспериментально найденной величины 5 3 ккал / моль. [10]
В результате термохимических измерений, проведенных с тщательно очищенными образцами лактонов III и-VI, найдено, что энтропия формы кресло-ванна III на 5 3 ккал / моль выше, чем формы кресло - кресло VI. Модель лактона III показывает, что кольцо в этом соединении имеет форму несколько искаженной правильной ванны. Измерение взаимно не сокращающихся взаимодействий для двух лактонов ( табл. 7) приводит к энергетическому различию в 4 7 ккал / моль, что не слишком отличается от экспериментально найденной величины 5 3 ккал / моль. [11]
 |
Молярная энтропия некоторых веществ при 25 С и 1 атм. [12] |
Вычисление изменений энтропии основывается на результатах термохимических измерений, но определение абсолютных значений энтропии требует, кроме того, установления условной точки ее отсчета. Принято, что энтропия совершенного кристалла при температуре абсолютного нуля равна нулю ( в такой системе полностью устраняется всякая неупорядоченность) и что энтропия всех веществ при приближении к О К стремится к нулю. [13]
Величины термодинамических функций, определяющих равновесия, находят для отдельных веществ из результатов термохимических измерений теплоемкости при низких температурах. Последние измерения могут быть заменены расчетом на основании спектроскопических данных. В следующих ниже параграфах мы выводим уравнения, позволяющие вычислять константы равновесия реакций с помощью величин, определенных путем термохимических измерений или рассчитанных по данным структур и энергетических свойств молекул. [14]
Определяются эти величины по спектральным данным ( см. § 25), по результатам термохимических измерений или другими путями. Соотношения между этими величинами являются наиболее простыми для двухатомных молекул. [15]
Страницы: 1 2