Результат - исследование - равновесие
Cтраница 1
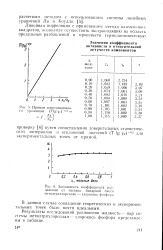 |
Прямая корреляционного уравления ( Т lg yi - 5.| Заинснмость коэффициента разделения от состава бинарной смеси метилтрихлорсилан - хлорокись фосфора. [1] |
Результаты исследований равновесия жидкость - пар системы метилтрихлорсилан-хлорокись фосфора представлены в таблице. [2]
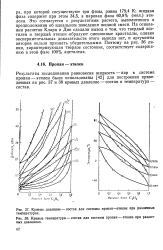 |
Кривые давление - состав для системы пропан-этилен при различных.| Кривые температура - состав для системы пропан - этилен при различ. [3] |
Результаты исследования равновесия жидкость - пар в системе пропан - этилен были использованы [42] для построения приведенных на рис. 37 и 38 кривых давление - состав и температура - состав. [4]
Результаты исследования равновесия жидкость - пар в системе ТГФС-ФС представлены в таблице. [5]
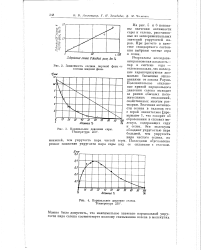 |
Зависимость состава паровой фазы от состава жидкой фазы.| Парциальное давление серы. Температура 250.| Парциальное давление селена. Температура 250. [6] |
Результаты исследования равновесия жидкость - пар в системе сера - селен показали, что последние характеризуются аномально большими отклонениями от закона Рауля. Положительное отклонение кривой парциального давления селена выходит за рамки обычных положительных отклонений, свойственных многим растворам. Значения активности селена в сплавах его с серой значительно [ превышают 1, что говорит об образовании в сплавах молекул, содержащих серу и селен. Эти молекулы обладают упругостью пара большей, чем упругость пара чистого селена, но Последним обусловлено ее сплавами с селеном. [7]
Результаты исследования равновесий с участием COS могут служить более точным источником сведений о ее теплоте образования. [8]
Результаты исследований равновесия КО - Н2Оч КОН ОН -, которые хотя и с трудом поддаются количественной интерпретации, также указывают на то, что кислотность в ряду Н2О, МеОН и EtOH меняется не более чем на порядок. [9]
Часто результаты исследования равновесия получают для относительно концентрированных растворов и не делают попыток по величинам концентрации найти активности. Константы равновесия, вычисленные с использованием концентраций, а не активностей, называют концентрационными константами; они количественно точны только для тех условий, при которых их определяли. [10]
Представлены результаты исследования равновесия адсорбции особо чистых моносилана, моногермана, аренда и фосфина на силикагеле и синтетических цеолитах при температурах от 10 до 70 С и давлении до 760 мм рт. ст. Адсорбция исследованных гидридов на цеолитах обратима и может быть описана в рамках теория объемного заполнения микропор. Совместная адсорбция влаги и гидрида на цеолитах не приводит к разложению гидрида и мало влияет на емкость по влаге. [11]
В работе содержатся результаты исследования равновесия L-V для системы альдегид - спирт и для тройной системы при 760 мм рт.ст., а также данные о равновесии L - L для тройной системы при 20 С. [12]
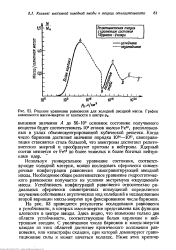 |
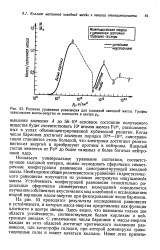
Решение уравнения равновесия для холодной звездной массы. График зависимости массы-энергии от плотности в центре р0. [13] |
На рис. 53 приводятся результаты исследования равновесия и устойчивости, в которых масса-энергия представлена как функция плотности в центре звезды. Здесь видно, что возможны только две области устойчивости, соответствующие белым карликам и нейтронным звездам. С увеличением числа барионов и массы-энергии каждая из этих областей достигает критического положения равновесия, или катастрофы складки, при которой доминируют гравитационные силы и может начаться коллапс. [14]
 |
Решение уравнения равновесия для холодной звездной массы. График зависимости массы-энергии от плотности в центре р0. [15] |
Страницы: 1 2 3 4