Результат - спектроскопическое исследование
Cтраница 3
Задачи интерпретации химических данных, рассмотренные в предыдущих главах, были связаны с установлением химической структуры из определенных экспериментально величин, причем в основном использовались результаты спектроскопических исследований. [31]
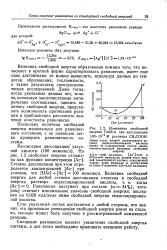 |
Изменение свободной энергии Гиббса при диссоциации. [32] |
Величина свободной энергии образования помимо того, что позволяет в краткой форме характеризовать равновесия, имеет еще одно достоинство: ее можно вычислить, используя данные по теп-лотам образования, теплоемкости, а также результаты спектроскопических исследований. [33]
Если равновесие реакций обмена лигандов устанавливается достаточно медленно, как, например, в случае Сг ( Н2О) и Co ( NH3) 5H2O3, то число молекул в первой гидратной оболочке может быть определено прямым химическим анализом. Используя результаты спектроскопических исследований, теория поля лигандов предсказывает возможную природу гидратированных частиц в растворе. Так, хотя обычно ион меди в узлах кристаллической решетки находится в виде иона Си ( Н2О), доказано что в растворе основной его формой является Cu ( H2O) g 1, причем две молекулы воды расположены на большем расстоянии, чем четыре другие. [34]
Дан обзор экспериментальных исследований влияния растворителя на структуру комплексов с сильной водородной связью и на вид и положение равновесий, существующих в системах с переходом протона. Изложены результаты оригинальных спектроскопических исследований роли подвижности молекулярного окружения в процессах установления равновесий, обусловленных переходом протона. На основе простой электростатической модели построена сх & ма, позволяющая проанализировать свойства поверхностей потенциальной и свободной энергий системы донор протона акцептор протона растворитель и охарактеризовать роль энтропийного фактора в качественном виде наблюдаемой на опыте картины. [35]
Именно аномально низкое значение частоты валентного колебания атома водорода ( - 705 см 1) в спектре комплекса NH3 HC1 в матрице из N2 послужило основанием для вывода [85] о том, что связь в этом комплексе близка к центральной. Основываясь на результатах дифракционных и спектроскопических исследований, авторы работ [80, 81, 86] подразделяют кислые соли карбоновых кислот на несколько типов, различающихся степенью симметрии потенциальной функции. При этом к типу А с центрально-симметричным протоном относят соли, в ИК-спектре которых присутствует широкое интенсивное поглощение в области 1500 - - 600 см - а в более высокочастотной области не наблюдается никаких полос, которые можно было бы приписать продольным колебаниям атома водорода. Имеются, однако, и другие примеры. [36]
Именно аномально низкое значение частоты валентного колебания атома водорода ( - 705 см 1) в спектре комплекса NH3 HC1 в матрице из N2 послужило основанием для вывода [85] о том, что связь в этом комплексе близка к центральной. Основываясь на результатах дифракционных и спектроскопических исследований, авторы работ [80, 81, 86] подразделяют кислые соли карбоновых кислот на несколько типов, различающихся степенью симметрии потенциальной функции. При этом к типу А с центрально-симметричным протоном относят соли, в ИК-спектре которых присутствует широкое интенсивное поглощение в области 1500 - 600 см 1 -, а в более высокочастотной области не наблюдается никаких полос, которые можно было бы приписать продольным колебаниям атома водорода. Имеются, однако, и другие примеры. [37]
Двойная связь в органическом радикале алкиленсилана, находящаяся в р-положении ( аллильный радикал) по отношению к атому кремния, значительно более активна. Об этом свидетельствуют результаты спектроскопических исследований и легкость присоединения к двойной связи брома или бромистого водорода. С увеличением количества аллильных радикалов в молекуле мономера активность каждой двойной связи возрастает. [38]
Кроме того, результаты спектроскопических исследований монокристаллов ( рис. 11) указывают, что, поскольку наблюдаются малые поляризационные изменения в области Соре между высокоспиновым фер-ри-состоянием и низкоспиновыми ферри - и ферро-состояниями, порфириновые группы в гемоглобине не имеют одинаковых ориентации для всех состояний координации. [39]
Эти выводы подтверждаются результатами спектроскопического исследования соответствующих сопряженных систем, а также изучением их химической реакционноспособности. [40]
Сведения о параметрах линий колебательных спектров представляют значительный интерес как для теории химического строения, так и для молекулярного спектрального анализа. В настоящей работе приведены результаты спектроскопического исследования гексаметилдисилоксана ( СН3) з5ЮЗЦСН3) з трет-бутокситриметилсилана ( СН3) 38ЮС ( СН3) 3 и ди-трет-бутилового эфира ( СН3) 3СОС ( СН3) 3, сопоставление физических свойств которых представляется весьма важным для решения проблемы о взаимоотношении аналогично построенных кислородных соединений кремния и углерода. Для них нами измерены частоты в спектрах комбинационного рассеяния и инфракрасных спектрах, интегральные интенсивности, степени деполяризации и ширины линий комбинационного рассеяния, вычислены стандартные интенсивности, произведена оценка силовых коэффициентов остова молекулы. Колебательные спектры ( СН3) 3СОС ( СН3) 3 приводятся нами впервые. [41]
В ряде работ, большей частью наряду со спектроскопическими исследованиями других веществ, были сняты ультрафиолетовые спектры поглощения [125, 289, 296, 453-458] и ИК-спектры [459] диазоаминобензола и некоторых триазенов. В работе [285] приведены результаты магнитных и спектроскопических исследований комплексов диазоаминобензола с медью, никелем и кобальтом. [42]
В 1950 г. Аллен и Саттон напечатали сводку [23] результатов, полученных главным образом электронографическим методом в парах, а также сопоставимые данные других методов. Согласно этому принципу в сводку включены результаты спектроскопических исследований, но опущены данные, полученные рентгенографическим методом применительно к кристаллам органических соединений. [43]
Хотя результаты этих экспериментов не допускали вполне однозначной трактовки, все же они давали основания для сомнения s том, что строение комплекса в газе и в растворе действительно мало отличается. То же можно сказать и о результатах спектроскопических исследований таких комплексов в низкотемпературных матрицах из инертных газов [10-11] или в жидких растворах в кислороде и азоте [12], которые показали, что в этих условиях многие комплексы, образованные весьма сильными кислотами и основаниями, не имеют ионной структуры с перешедшим протоном, как в инертных растворителях. [44]
Сравнение термографических и термомеханических характеристик исходных полимеров и продуктов их совмещения позволяет предположить, что в присутствии гексаметилентетрамина происходит сшивание линейных цепей ПВХ и новолачной смолы метиленовыми группами. Образование химической связи подтверждается данными по растворимости и результатами спектроскопических исследований. [45]
Страницы: 1 2 3 4