Большее значение - константа - равновесие
Cтраница 1
Большие значения констант равновесия, полученные для реакций ( 1) и ( 2), показывают, что эти реакции практически полностью протекают слева направо. [1]
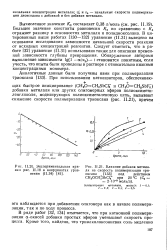 |
Влияние добавок метилаля на скорость полимеризации триоксана под действием CH3OCHjSbCle при 20 С ( С0 2 - 10 - 3 моль / л. [2] |
Большее значение константы равновесия К2 по сравнению с / d отражает разницу в основностях метилаля и полидиоксолана. В цитированных выше работах [130-132] уравнение (11.31) выведено на основании исследования зависимости начальной скорости реакции от исходных концентраций реагентов. Следует отметить, что в работе [32] уравнение (11.31) использовано также для описания временной зависимости глубины превращения. Обнаруженное авторами выполнение зависимости lg ( l - - а / ар) - t становится понятным, если учесть, что опыты были проведены в растворе с относительно низкими концентрациями мономера. [3]
Большие значения констант равновесия реакций С -) - 02С02 и 2С - - 02 - 2СО при всех температурах показывают, что эти реакции практически протекают до конца в прямом направлении. Реакция горения окиси углерода 2СО - f - 02 2С02, так же как и реакции полного и неполного горения углерода, практически идет полностью в прямом направлении. [4]
Большим отрицательным значениям изменения энергии Гиббса соответствуют большие значения констант равновесия, свидетельствующие о том, что в реакционной смеси больше продуктов реакции, чем реагентов. [5]
Очевидно, что высокая степень полимеризации может быть достигнута при больших значениях константы равновесия и малом содержании воды в реакционной смеси. [6]
В отличие от реакций поликонденсации, ведущих к образованию карбоцепных полимеров ( например реакции фенола с альдегидами), которые характеризуются большим значением константы равновесия ( К - 10 000) и для которых установление равновесия практически не играет роли ( стр. [7]
В отличие от реакций поликонденсации, ведущих к образованию карбоцепных полимеров ( например реакции фенола с альдегидами), которые характеризуются большим значением константы равновесия ( К. [8]
Взаимодействие фенолов с альдегидами представляет собой-реакцию поликонденсации, условием протекания которой является полифункциональность регулирующих молекул. Реакция характеризуется большим значением константы равновесия ( / С-ЮООО) и, следовательно, практически протекает в одном направлении даже в водной среде - в сторону образования полимера. Вследствие этого кинетика и степень поликонденсации практически зависит от концентрации катализатора, температуры и времени реакции, а не удаления побочных продуктов реакции. [9]
В работах [5-7] рассмотрены возможности и недостатки этих методов. Было показано [7], что значение предельной адсорбции может быть приближенно найдено только для систем с большим значением константы равновесия. [10]
Несмотря на то, что реакций, идущих до полного превращения, не существует, многие реакции вследствие больших значений констант равновесия можно считать необратимыми. [11]
Для восстановления ионов металлов в растворах используют электроннообменные смолы и волокна, которые не загрязняют раствор избытком восстановителя. Некоторые высокомолекулярные электроннообменники этого типа обладают способностью концентрировать восстановленный металл в себе и поэтому могут применяться непосредственно для извлечения ионов и соединений металлов из пульп. Учитывая большие значения констант равновесия и высокую скорость окислительно-восстановительных реакций, можно полагать, что электроннообменные смолы и волокна в будущем вытеснят иониты из отдельных производств и в первую очередь из области глубокого доизвлечения некоторых ценных элементов из растворов и пульп. Следует заметить, что электронно-обменные смолы и волокна с высоким редокс-потенциалом представляют значительный интерес как окислители в процессах выщелачивания и очистки растворов. [12]
Напомним, что через - ДЯ обозначается выделяющееся при реакции тепло, Логарифм константы ( и тем более константа) будет, следовательно, тем больше, чем более экзотермична реакция при прочих равных условиях. Однако вторым не менее важным слагаемым является член, содержащий приращение энтропии AS, который может обеспечить большие значения константы равновесия и в случае эндотермических реакций. [13]
Страницы: 1