Результат - более поздняя работа
Cтраница 2
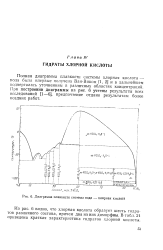 |
Диаграмма плавкости системы вода - хлорная кислота. [16] |
Полная диаграмма плавкости системы хлорная кислота - вода была впервые получена Ван-Виком [1, 2] и в дальнейшем подвергалась уточнениям в различных областях концентраций. При построении диаграммы на рис, 6 учтены результаты всех исследований [1-6], предпочтение отдано результатам более поздних работ. [17]
Длина волны полосы, соответствующей второму переходу, несколько меньше 2000 А, и в ацетоне ( где можно ожидать такую же картину) ее интенсивность хорошо совпадает с интенсивностью полосы, ожидаемой в случае перехода в состояние Ez. Можно считать, что эти данные вместе с данными анализа вращательной структуры некоторых колебательных полос в длинноволновой части спектра формальдегида [8], а также с результатами более поздних работ, посвященных исследованию тонкой структуры полосатых спектров, достаточно надежно подтверждают предположение, согласно которому полоса 3700 А соответствует запрещенному п-япереходу. [18]
 |
Кинетика взаимодействия атомного водорода и дейтерия с молекулярным водородом и дейтерием. [19] |
Реакции с метаном, этаном, пропаном, нормальным и изобутаном при комнатной температуре были изучены Стиси и Трестом. Они получили значения энергии активации 54 4 кДж / моль для метана, около 37 7 кДж / моль для этана и 41 8 кДж / моль для пропана и обоих бутанов. Результаты более поздних работ не согласуются с этими цифрами. [20]
 |
Кинетика взаимодействия атомного водорода и дейтерия с молекулярным водородом и дейтерием. [21] |
Реакции с метаном, этаном, пропаном и нормальным изобутаном при комнатной температуре были изучены Стиси и Трестом. Они получили значения энергии активации 54 4 кДж - моль-1 для метана, около 37 7 кДж - моль 1 для этана и 41 8 кДж - моль 1 для пропана и обоих бутанов. Результаты более поздних работ не согласуются с этими цифрами. [22]
 |
Кинетика взаимодействия атомного водорода и дейтерия с молекулярным водородом и дейтерием. [23] |
Реакции с метаном, этаном, пропаном, нормальным и изобутаном при комнатной температуре были изучены Стиси и Трестом. Они получили значения энергии активации 54 4 кДж / моль для метана, около 37 7 кДж / моль для этана и 41 8 кДж / моль для пропана и обоих бутанов. Результаты более поздних работ не согласуются с этими цифрами. [24]
Величины АЯ получены из температурной зависимости КЛ, за исключением ацетальдегида, для которого имеются также калориметрические данные. Это связано с тем, что, хотя при приведении к 25 ( АЯ 6 ккал / моль) данные Герольда для хлорацетонов и биацетила согласуются с другими данными из табл. 1, данные для пяти алифатических альдегидов значительно расходятся с результатами более поздних работ; это расхождение особенно проявляется в том, что изменение Кд с изменением длины цепи имеет противоположное направление. [25]
Страницы: 1 2