Результат - расчет - молекула
Cтраница 1
Результаты расчетов молекул XXI-XXIV приводят еще к одному интересному вопросу. Замещение в положение 8 в хи-нолине ( XXII) или в положение 5 в изохинолине ( XXIII) идет через промежуточный ион, в котором атом азота находится в неактивном положении. Эти реакции также должны были бы идти через промежуточные соединения, для которых йн равны нулю. Оно включает член - рЛ / ь определяющий место атаки в соответствующем изосопряженном альтернантном углеводороде. Поскольку Nt для ос-положения нафталина ( 1 81) гораздо меньше, чем для, р-положения ( 2 12), атака происходит предпочтительно в а-положение. Такая же предпочтительность а-по-ложения сохраняется при переходе к хинолину и изохинолину. Поэтому замещение в р-положение может стать предпочтительным, только если последний член в уравнении (9.52) перевешивает это отличие. Очевидно, это не происходит, так как всегда более благоприятным является а-положение. [1]
 |
Энергетическая диаграмма и графические изображения граничных молекулярных орбиталей акролеина. [2] |
Результаты расчета молекулы акролеина методом МОХ подробно обсуждены ранее. На рис. 19.5 показаны лишь уровни энергий его граничных орбиталей и их графические изображения. Ниже приводятся также собственные коэффициенты граничных орбиталей акролеина. [3]
В табл. 12.1 собраны результаты расчетов молекулы Н2, упоминавшиеся в гл. [4]
Таким образом, в результате расчета молекулы метана в валентном базисе получают восемь МО. [5]
Энергия делокализации л-электронов в молекуле 1 3-бутадиена может быть определена и по результатам расчетов молекулы 1 3-бутадиена методом МОХ. [6]
Эти данные, в соответствии с данными по восстановлению тетрациклона химическими средствами [91] и с результатами расчета молекулы тетрациклона методом молекулярных орбит [92], свидетельствуют, что положения 3 и 4 существенно не отличаются от положения 1 в отношении нуклеофильной реакционной способности. [7]
В споем общем виде, разработанном Слейтером, Полинпш и др., метод валентных связей опирается на результат расчета молекулы Н2) согласно к-рому хгшич. В основном состоянии молекулы должно быть образовано максимально возможное число химич. [8]
В своем общем виде, разработанном Слейтером, Полингом и др., метод валентных связей опирается на результат расчета молекулы На, согласно к-рому химич. В основном состоянии молекулы должно быть образовано максимально возможное число химич. [9]
 |
Результаты квантовомеханического расчета молекулы водорода. [10] |
Не рассматривая данный расчет, можно пояснить его результат исходя из того, что было сказано выше о результатах расчета молекулы Н2 - Присоединение третьего атома к молекуле Н2 невозможно, поскольку условием для перекрывания электронных облаков, которое дает химическую связь, является наличие у электронов антипараллельных спинов. Поэтому между третьим атомом водорода и молекулой водорода будут действовать силы отталкивания, подобные тем, которые появляются при сближении двух атомов водорода с параллельными спинами. [11]
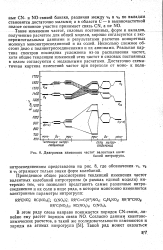 |
Диаграмма изменения частот валентных колебаний нитрогрупп. [12] |
Такие изменения частот, силовых постоянных, форм и вкладов, полученные расчетом для общей модели, хорошо согласуются с экспериментальными данными и результатами расчетов конкретных молекул мононитросоединений и их солей. Несколько сложнее обстоит дело с полинитросоединениями и их анионами. Реальная картина спектров последних усложнена из-за расщепления частот, хотя общие тенденции изменений этих частот и силовых постоянных в целом согласуются с модельными расчетами. [13]
В табл. 6.13 иллюстрируется важная роль высших гармоник для молекулярных систем. Здесь представлены результаты расчетов молекулы моноксида углерода с использованием базисных наборов функций s -, р - и d - симметрии, а также базисных наборов функций s -, p -, d - и f - симметрии [748] и показана зависимость энергий матричного метода Хартри - Фока и корреляционных энергий, полученных диаграммным методом теории возмущений, от геометрии ядер. [15]
Страницы: 1 2