Точное значение - константа - скорость
Cтраница 1
Точные значения констант скоростей этих реакций неизвестны. [1]
Точные значения констант скоростей определить непросто, так как для этого нужно знать скорость, концентрацию и температуру. Скорость реакции обычно очень чувствительна к изменению температуры, так что основная трудность заключается в поддержании постоянной температуры. Трудность усугубляется тем, что сама реакция часто идет с выделением или поглощением тепла, что также способствует изменейию температуры реакционной смеси. [2]
Таким образом, получить точное значение константы скорости реакции мы не можем, поскольку величина растворимости газов ( кроме кислорода [14]) в облученном кристаллическом тефлоне неизвестна. [3]
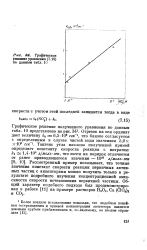 |
Графическое решение уравнения по данным 10. [4] |
Рассмотренный пример показывает, что точные значения констант скорости реакции первичных активных частиц с акцепторами можно получить только в результате подробного изучения концентрационной зависимости скорости исчезновения первичной частицы. [5]
Отметим, что часто знание точного значения константы скорости химической реакции не является необходимым: так, в области протекания мгновенной реакции, о существовании которой можно судить, например, по сильной зависимости скорости массопередачи от параметра М и по значительной доле диффузионного сопротивления в газовой фазе, для расчета вообще не требуется величина гп. [6]
В случае если активной является лишь одна форма реагирующей частицы и невозможно найти точное значение константы скорости, проводят эксперимент в области рН, в которой реагирующее вещество полностью превращено в активную форму, а значения рК и предельной константы скорости можно получить, используя методы экстраполяции. [7]
Достаточным свидетельством в пользу того, что реакция строго описывается кинетическими уравнениями первого порядка, является демонстрация справедливости уравнения при временах реакции до трех-четырех периодов полупревращения. Точные значения констант скоростей можно получать при исследовании реакции в течение двух периодов полупревращения, если достаточно точно определено предельное значение. В некоторых случаях достаточную точность определения константы скорости можно получить и при изучении реакции в течение одного периода полупревращения, если точно установлено, что реакция подчиняется кинетике первого порядка. Однако отклонения от кинетики первого порядка вследствие неправильного определения предельного значения или по каким-либо другим причинам могут не проявиться при исследовании реакции в течение одного или даже двух периодов полупревращения, так что, если не установлено, что реакция строго подчиняется кинетике первого порядка, значения констант скоростей могут получиться с большой ошибкой. [8]
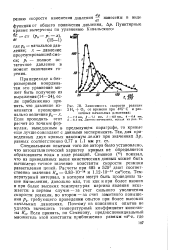 |
Зависимость скорости реакции 2 Н - J - О2 от времени при 4Я5 С и различных начальных давлениях. [9] |
Специальными опытами того же автора было установлено, что автокаталигический характер кривых не определяется образованием воды в ходе реакций. Семенов ( ц) показал, что из приведенных выше кинетических данных может быть вычислено точное значение константы скорости реакции разветвления цепей. Расчеты при 485 и 520 дают соответственно значения Kz 0.83 - 10 - 14 и 1.12 - 10 - см3 / сек. Температурный интервал, в котором могут быть проведены такие вычисления, довольно мал, так как и при более низких и при более высоких температурах картина явления искажается: в первом случае - за счет сильного увеличения скорости реакции, во втором - за счет заметного повышения pv требующего проведения опытов при более высоких начальных давлениях. [10]
Применение ЭВМ, позволяющее осуществить численный расчет задачи о скорости распространения пламени любой степени сложности, ознаменовало новый период в развитии теории горения. Вместе с тем машинные расчеты поставили ряд требований, касающихся необходимости формулирования задачи на основе точного, детального механизма реакции горения, точных значений констант скорости химических процессов, входящих в механизм реакции, точных значений коэффициентов диффузии и теплопроводности, без чего результаты расчетов не могут считаться надежными. Стало совершенно очевидным, что все эти требования на современном этапе не могут быть удовлетворены. [11]
Колебательное возбуждение окиси азота в реакции невелико, поэтому из этих экспериментов, а также из аналогичных экспериментов с реакциями О СЮ2, О Оз и O RH вытекает естественный вывод, что основное колебательное возбуждение приходится на вновь образующуюся связь. Полуколичественные измерения показали, что только небольшая доля эк-зотермики этих реакций выделяется в форме колебательной энергии. Было бы чрезвычайно интересно получить точные значения констант скоростей реакций образования продуктов в каждом квантовом состоянии. [12]
Известно, конечно, множество простых газофазных реакций, которые сопровождаются переносом атомов водорода. Практически такая проверка оказывается не совсем убедительной по следующим причинам. Во-первых, получить точные значения констант скорости в большом интервале температур часто трудно. Кроме того, когда несколько лепких атомов движутся одновременно, координата реакции является сложной функцией положений атомов. Анализ неэмпирических расчетов поверхно стей потенциальной энергии для простых газофазных реакций, проведенный в недавней статье [103], показал, что даже в случае очень простых систем, таких, как Н Н2 или С1 Н2 ( где Н и Н2 могут быть любыми изотопами водорода), наиболее точные из до сих пор опубликованных расчетов все же недостаточно хороши для вычисления туннельных поправок. Общий вывод, который следует ш всех этих работ, состоит в том, что даже при умеренных температурах туннельная поправка является значительной. Однако еще нельзя решить вопрос о том, насколько адекватно для описания реальных реакций использование модели одномерного барьера, а также получить подробную информацию о форме энергетической поверхности. [13]
Страницы: 1