Роль - комплексообразователь
Cтраница 2
Если в результате ОВР образуются комплексные соединения, в которых роль комплексообразователя играют потенциалопределяю-щие ионы, то концентрация этих ионов в растворе резко уменьшается. Вследствие этого потенциалы соответствующих полуреакций изменяются, что может привести к изменению направления ОВР. [16]
Приведите примеры реакций, при которых ионы металлов подгруппы меди выступают в роли комплексообразователей. [17]
При положительной степени окисления водород образует только ковалентные соединения и может играть роль комплексообразователя в анионных комплексах. [18]
Уран образует многочисленные комплексные соединения с органическими кислотами: помимо упомянутых выше щавелевой и уксусной кислот роль комплексообразователя выполняют также винная, лимонная, салициловая и многие другие органические кислоты. Получены соединения сульфата, хлорида, оксала-та, нитрата уранила с тиомочевиной, фенантролином, дипириди-лом ( 957 ]; подробно изучен оксихинолят уранила UC CgHsNOb - C9H7NO, осаждающийся из щелочных и слабокислых ( уксуснокислых) растворов, и хорошо растворимый в органических растворителях, например в хлороформе или спирте с желто-коричневым окрашиванием, используемым для колориметрического определения урана. [19]
Интересными антиоксидантами для поливинилхлорида являются алкил - и арилфосфиты, которые, очевидно, одновременно выполняют и роль комплексообразователей ( см. стр. [20]
Многие растворители, например диметилсульфоксид ( СНзЬЗО, диметилформ-амид ( CHabNCHO, пиридин CeH5N, сами играют роль комплексообразователей. [21]
Согласно современным воззрениям, меркуро-ион можно считать комплексным ионом [ Hg Hg ], в котором Hg играет роль комплексообразователя. [22]
Иоиы металлов в растворах с анионами или нейтральными частицами образуют комплексы, например FeCU, [ Си ( ЫНз) 4 ] 2 - В этом случае катион металла выступает в роли комплексообразователя М, а ион С1 - или молекула ЫНз - комплексообразующего реагента, называемого также лигандом или аддеидом. Атом лигаида, иепосредствеиио образующий связь с комплексообразователем, называют доиориым атомом. Комплексы обладают характерным пространственным строением, например AgClr - линейная молекула, а в [ Си ( ЫНз) 4 ] 2 молекулы аммиака расположены по углам тетраэдра. Металл, центральный атом комплекса, координирует вокруг себя молекулы лигаидов. Поэтому комплексы металлов часто называют также координационными соединениями. Лигаиды, непосредственно связанные с центральным атомом комплекса, образуют его внутреннюю координационную сферу с определенным числом координационных мест. [23]
Комплексное соединение [ Fe ( CO) 5 ] состоит только из внутренней координационной сферы, которая имеет форму триго-нальной бипирамиды. Роль комплексообразователя в ней играет атом железа, лигандами являются пять молекул оксида угле-рода ( П) СО. [24]
Центральный атом внутренней сферы, вокруг которого группируются ионы или молекулы, называется комплексообразователем или ядром комплекса. Роль комплексообразователей чаще всего выполняют катионы металлов, реже нейтральные атомы или анионы. Ионы или молекулы, координирующиеся вокруг центрального атома во внутренней сфере, называются лигандами. [25]
 |
Некоторые комплексы металлов в МВС. [26] |
МВС дает возможность трактовать комплексы с нейтральными лигандами. Например, в карбонилах роль комплексообразователей играют атомы переходных металлов с нулевой степенью окисления. Лигандами являются нейтральные молекулы оксида углерода. Кар-бонилы - диамагнитные вещества, поскольку все электроны металла спарены. [27]
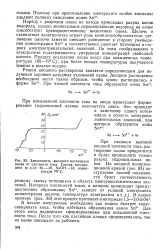 |
Зависимость анодного потенциала олова от плотности тока. Состав электролита ( в г / л. Sn-28, NaOH-13. температура 70 С. [28] |
Наряду с разрядом олова на катоде происходит разряд ионов водорода, однако значительное перенапряжение водорода на олове способствует преимущественному выделению олова. Щелочь в станнатных электролитах играет роль комплексообразователя; увеличение щелочи заметно смещает равновесие в сторону уменьшения концентрации Sn4 и соответственно сдвигает потенциал в сторону электроотрицательных значений. По этим соображениям в электролите поддерживается умеренная концентрация свободной щелочи. Процесс осаждения олова ведут при повышенных температурах ( 65 - 70 С); при более низких температурах получаются темные и рыхлые осадки. [29]
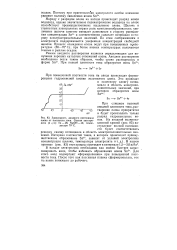 |
Зависимость анодного потенциала олова от плотности тока. Состав электролита ( в г / л. Sn - 28, NaOH - 13. температура 70 С. [30] |
Страницы: 1 2 3 4