Кислородный аналог
Cтраница 1
Кислородные аналоги значительно более ядовиты, чем тпо-производные, и представляют большую опасность для теплокровных животных. [1]
Кислородным аналогом отщепления через илиды по Виттигу является реакция отщепления, подробно изученная Коупом. [2]
Для кислородных аналогов подобного типа сопряжение невозможно из-за отсутствия у атома кислорода Зс. Если связать неподеленную пару, электронов атома серы путем окисления до сульфона, то при этом сопряжение по типу ( б) становится невозможным. [3]
Пироны - кислородные аналоги пиридонов - представляют собой депро-тонированные а - и у-гидроксипирилиевые соли. Есть лишь немного поводов для того, чтобы рассматривать эти соединения как ароматические; вероятно, лучше всего рассматривать а - и у-пироны как ненасыщенные циклические лак-тоны и р-гидрокси-а р-ненасыщенные кетоны соответственно. Примечательно, что пироны превращаются в соответствующие пиридоны при взаимодействии с аммиаком, в то время как из пиридонов ни при реакции со щелочью, ни при взаимодействии с водой пироны не могут быть получены. Для пиронов и бензопиронов известно несколько реакций электрофильного замещения при атоме углерода, кислородный заместитель направляет атаку электрофила в орто - и иярд-положения. В этом случае также происходит электрофиль-ное присоединение по двойной связи, что дополнительно свидетельствует в пользу неароматического характера этих соединений. Легко осуществимые реакции Дильса-Альдера с участием диеновой системы 2-пиронов еще раз подтверждают изложенное выше. [4]
Кумарандион-2 3, кислородный аналог изатина, может быть получен различными способами. [5]
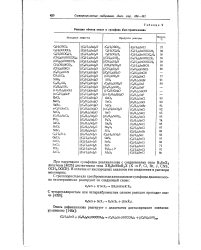 |
Реакции обмена окиси и сульфида бис-триэтилолова. [6] |
В отличие от кислородных аналогов эти соединения в растворе мономерны. [7]
Хотя диацилпероксид является кислородным аналогом гекса-1 5-диена, ППЭ термоизомеризации пероксида резко контрастирует с ППЭ перегруппировок Коупа и Кляйзена. Согласованные [3,3] - и [1,3] - сигма-тропные сдвиги не могут конкурировать с перегруппировкой через а-ацил-окси-радикальную пару, образование которой следует признать наиболее вероятной причиной рандомизации 8О - метки в диацилпероксидах. [8]
По сравнению с соответствующими кислородными аналогами преимущества тиоловых эфиров в нуклеофильных реакциях по карбонильному атому углерода, в реакциях присоединения по ( 3-атому углерода а ( 3-ненасыщен-в: ых субстратов и в реакциях конденсации по углероду в а-положении к карбонильной группе достаточно очевидны. В каждом случае тиоловые эфиры оказываются более активными, чем их кислородные аналоги. [9]
Диизопропилксантогендисульфид представляет интерес как кислородный аналог тетраалкилтиурамди-сульфидов. [10]
Известно [450, 451], что кислородный аналог ДВС-дивини-ловый эфир в присутствии свободнорадикальных инициаторов подвергается циклополимеризации с участием обеих двойных связей. Как было показано позже [452, 453], получаемые таким путем полимеры дивинилового эфира состоят в основном из насыщенных бициклических звеньев и в меньшей степени из моноциклических звеньев со свободными винилоксигруппами. [11]
Кетен можно рассматривать как кислородный аналог аллена СН2ССН2 ( см. главу 7) или метиловый аналог двуокиси углерода ОСО. [12]
Из неуглеводородных компонентов присутствуют сернистые, азотистые и кислородные аналоги углеводородов всех классов. Прочие элементы присутствуют в значительно меньших количествах. [13]
В отличие от своих кислородных аналогов ( нитроксильных радикалов), несмотря на стерические препятствия в области парамагнитного центра, иминотиил LXIV рекомбинирует около 90 С, а LXV около 140 С. [14]
Определение малатиона и его кислородного аналога - малаокоона методом ГХ. [15]
Страницы: 1 2 3 4