Вычисленное значение - константа
Cтраница 2
Так как Е легко определяется для любой реакции, то можно вычислить k для какой-либо температуры и сравнить ее с наблюдаемой на опыте величиной. Если диаметры молекул не известны в точности по измерениям вязкости или по другим данным, то их можно определить по молекулярным объемам или по парахорам веществ в жидком или твердом состоянии. Для ряда бимолекулярных реакций между простыми соединениями в газовой фазе вычисленные значения констант настолько близки к экспериментальным величинам, что вполне можно принять теорию активации в качестве общей основы для изучения скоростей реакций. Правда, ниже будет показано, что имеется много случаев, в которых существует заметное расхождение между обеими величинами, но эти расхождения рассматриваются как исключения и должны быть определенным образом истолкованы. [16]
В тех случаях, однако, когда точность экспериментальных данных весьма высока и все точки строго укладываются на одну прямую, для вычисления константы следует применять аналитические методы. В такие уравнения входят значения начальных концентраций, и поэтому ошибка в их определении сильно сказывается на всех вычисленных значениях констант. [17]
A приведенные в табл. 84, в сочетании с величинами первой константы гидролиза лутео-иона, которые, согласно данным табл. 78 и 80, можно считать правильными для данных ионных сил. Наконец, в последних двух колонках табл. 84 представлены значения k & и lg &6, рассчитанные на основании сказанного выше. При рассмотрении вычисленных значений шестой константы устойчивости, видно, что IgAs растет приблизительно линейно с увеличением концентрации соли. [18]
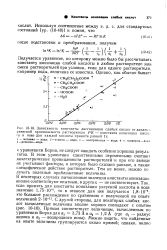 |
Зависимость константы диссоциации слабых кислот от диэлект-рической проницаемости растворителя ( ЕК - константа ионизации кисло-гы в воде для каждой кислоты принята равной 1. [19] |
Борна, не следует ожидать особенно хороших результатов. В этом уравнении единственными переменными считают диэлектрические проницаемости растворителей-и при его выводе не учитывают факторы, о которых было сказано раньше, а также специфическое действие растворителя. В некоторых случаях вычисленные значения константы ионизации вполне соответствуют опытным, в других - не соответствуют. [20]
 |
Зависимость константы диссоциации слабых кислот от диэлектрической проницаемости растворителя ( ВК - константа ионизации кислс-гы в воде для каждой кислоты принята равной 1. [21] |
Борна, не следует ожидать особенно хороших результатов. В этом уравнении единственными переменными считают диэлектрические проницаемости растворителей и при его выводе не учитывают факторы, о которых было сказано раньше, а также специфическое действие растворителя. В некоторых случаях вычисленные значения константы ионизации вполне соответствуют опытным, в других - не соответствуют. [22]
Получается уравнение, по которому можно было бы рассчитывать константу ионизации слабой кислоты в любом растворителе или смеси растворителей при условии, что для одного растворителя, например воды, значение ее известно. Однако, как обычно при расчетах по уравнению Борна, не следует ожидать особенно хороших результатов. В этом уравнении единственными переменными считают диэлектрические проницаемости растворителей, и при его выводе не учитывают факторы, о которых было сказано раньше, а также специфическое действие растворителя. В некоторых случаях вычисленные значения константы ионизации вполне соответствуют опытным, в других - не соответствуют. [23]
Страницы: 1 2