Численное значение - коэффициент - активность
Cтраница 1
Численное значение коэффициента активности зависит также от принятого способа выражения концентрации раствора. [1]
Условие определения численных значений коэффициентов активности обычно заключается в том, что эти величины принимаются равными единице в бесконечно разбавленном в данном растворителе растворе. К сожалению, принятое условие не исключает неопределенности, обусловленной изменениями, которые испытывают коэффициенты активности в водной среде при добавлении к воде диоксана, спирта и других органических жидкостей. Если коэффициент активности частиц г - го вида в различных растворителях отнесен к стандартному состоянию в воде, то в неводных растворителях с уменьшением концентрации растворенного вещества коэффициент активности будет приближаться к значению, отличному - от единицы. Этот предел является мерой величины, названной эффектом ( или влиянием) среды i i, и может значительно отличаться от единицы. [2]
Условие определения численных значений коэффициентов активности обычно заключается в том, что эти величины принимаются равными единице в бесконечно разбавленном в данном растворителе растворе. К сожалению, принятое условие не исключает неопределенности, обусловленной изменениями, которые испытывают коэффициенты активности в водной среде при добавлении к воде диоксана, спирта и других органических жидкостей. Если коэффициент активности частиц г-го вида в различных растворителях отнесен к стандартному состоянию в воде, то в неводных растворителях с уменьшением концентреции растворенного вещества коэффициент активности будет приближаться к значению, отличному от единицы. Этот предел является мерой величины, названной эффектом ( или влиянием) среды, у -, и может значительно отличаться от единицы. [3]
В зависимости от способа выражения концентрации численное значение коэффициента активности различно. Обычно используют коэффициент активности: Y - рациональный ( при выражении концентрации в мол. [4]
По кривым зависимости ч ч ( я) определяют - у - Численные значения коэффициентов активности подставляют в формулу (12.159) и рассчитывают К. [5]
В зависимости от величин межмолекулярного притяжения в неидеальных системах коэффициенты активности могут быть больше и меньше единицы. Численное значение коэффициента активности является функцией всех остальных компонентов в растворе и их концентраций. Например, для компонента А в двойной смеси уа 1, если ха 1, так как чистые жидкости рассматриваются как идеальные растворы. Такая же зависимость наблюдается и для других компонентов. [6]
В зависимости от величин межмолекулярного притяжения в неидеальных системах значения коэффициентов активности могут быть больше и меньше единицы. Численное значение коэффициента активности является функцией всех остальных компонентов в растворе и их концентраций. Например, для компонента А в двойной смеси ча1, если ха1, так как чистые жидкости рассматриваются как идельные растворы. Такая же зависимость наблюдается и для других компонентов. [7]
Очевидно, для растворов, проявляющих положительные отклонения от закона Рауля ( см. рис. 1.6), уравнение (1.70), определяющее коэффициент активности, сохраняет тот же общий вид, но сравнение величин - yi с единицей дает картину, обратную рассмотренной выше. Таким образом, численное значение коэффициента активности определяется выбором стандартного состояния. [8]
В литературе имеется большое количество работ, посвященных изучению влияния только одного ( реже нескольких) параметра процесса обмена на характер изменения селективности ионитов. Попытки термодинамического описания ионообменных равновесий с помощью константы равновесия осложнены необходимостью получения численных значений коэффициентов активности ионов как в фазе ионита, представляющей собой концентрированный раствор электролита, так и в растворе смеси электролитов. Подобные исследования сопряжены с большой экспериментальной трудностью и используются в основном для изучения равновесия в разбавленных растворах. Поэтому в настоящее время очень трудно, а чаще и совсем невозможно предсказать положение ионообменного равновесия, особенно для области умеренно концентрированных и концентрированных растворов. [9]
Вместо активности нередко пользуются величиной коэффициента активности YI - Он равен отношению активности к концентрации, и, например, для принятого нами выражения концентраций в мольных долях YI CLiINi и представляет собой тоже вспомогательную расчетную термодинамическую функцию. Коэффициент активности характер изует степень отклонения свойств рассматри-ваемо ТсГкомпонента в данном растворе от свойств его в соответ-ствуктщетгг простейшем растворе. Численное значение коэффициента активности зависит также от принятого способа выражения концентрации раствора. [10]
 |
Энтропии сольватации. [11] |
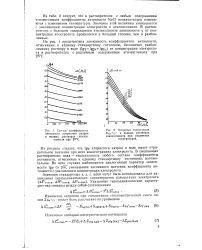
Из рисунка следует, чте Igy хлористого натрия в воде имеет отрицательное значение при всех концентрациях электролита. В смешанных растворителях вода - этиленгликоль любого состава коэффициенты активности, отнесенные к единому стандартному состоянию, положительны. Во всех случаях наблюдается аналогичный характер зависимости Igy от У / п уменьшение численного значения коэффициента активности с увеличением концентрации электролита. [12]
Страницы: 1