Свойство - гемоглобин
Cтраница 1
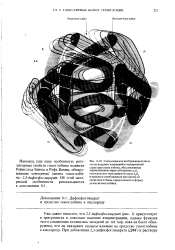
Свойства гемоглобина демонстрируют динамическое поведение белка. И третичная, и четвертичная структуры НЬ быстро и непрерывно осциллируют между окси - и дезоксм-конформа-циями. Присоединение лиганда вызывает сдвиг коиформацион-лого равновесия. [1]
Наконец, еще одну особенность регу-ляторных свойств гемоглобина выявили Рейнгольд Бенеш и Руфь Бенеш, обнаружившие четвертый лиганд гемоглобина - 2 3-дифосфоглицерат. [3]
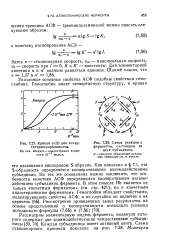 |
Кривая о ( S для аспар-таттраискарбамилазы.| Схема реакции с ферментом, состоящим из. [4] |
Указанные основные свойства АСФ подобны свойствам гемоглобина. [5]
Прямые, хотя и не очень надежные сведения о свойствах гемоглобина и миоглобина ( разд. Диамагнитные свойства комплекса FemO-2 могут быть следствием антиферромагнитного взаимодействия между спинами металла и лиганда. [6]
Для связывания большей части двуокиси углерода исключительно большое значение имеют свойства гемоглобина как кислоты. Оксигемоглобин имеет константу диссоциации в 70 раз большую, чем дезоксигемоглобчн. В тканевых капиллярах часть КНЬО2 отдает кислород и превращается в КНЬ. [7]
Физиологические адаптации к дефициту кислорода вызвали к жизни сходные адаптации в разных, далеко не родственных группах животных - например, однонаправленные изменения свойств гемоглобина в виде повышения его сродства к кислороду у ряда видов рыб, с одной стороны, и у высокогорных млекопитающих - с другой. Перестройка типов азотистого метаболизма при смене водной среды на воздушную ( в том числе переход к урикотелии) характеризует многие таксоны как беспозвоночных, так и позвоночных животных. [8]
При подъемах даже на большие высоты ( до 4000 м над уровнем моря), где воздух сильно разрежен и напряжение кислорода в альвеолярном воздухе падает до 60 мм рт. ст., кровь человека все еще на 85 % насыщена кислородом. Это свойство гемоглобина крови обеспечивает возможность жизни человека и животных в высокогорных условиях. [9]
В процессе транскрипции это изменение передается на мРНК и приводит к замене в некотором участке полипептидной цепи гемоглобина глутаминовой кислоты на валин. Это настолько меняет свойство гемоглобина, что эритроциты вместо своей обычной сферической формы приобретают серповидную. [10]
Биологические функции белков исключительно разнообразны. Выше уже были упомянуты свойства гемоглобина млекопитающих как переносчика кислорода. Функция некоторых белков крови заключается в образовании антител, обусловливающих сопротивляемость к заболеваниям, а так называемые нуклеопротеиды входят в качестве важной составной части в гены, которые несут наследственную информацию и передают ее в процессе деления клетки. Вирусы, например вирус табачной мозаики, состоят из нуклеопротеидов, заключенных в белковую оболочку. Структура многих вирусов настолько регулярна, что они могут быть получены в виде хорошо образованных кристаллов. [11]
Биологические функции белков исключительно разнообразны. Выше уже были упомянуты свойств гемоглобина млекопитающих как переносчика кислорода Функция некоторых белков крови заключается в обраеэванш антител, обусловливающих сопротивляемость к заболеваниям а так называемые нуклеопротеиды входят в качестве важно. Вирусы, на пример вирус табачной мозаики, состоят из нуклеопротеидов заключенных в белковую оболочку. [12]
Структурные аномалии гемоглобина, приводящие к клиническим признакам болезни, называют гемоглобино-патиями. При этом изменяется одно из трех свойств гемоглобина: растворимость; сродство к кислороду; устойчивость к денатурации. Изменение растворимости наблюдается при серповидноклеточной анемии: эритроциты содержат HbS, у которого в р-цепи в 6 - м положении вместо глутаминовой кислоты находится валин. Такое замещение полярного радикала на неполярный приводит к резкому снижению растворимости дезоксигемоглобина S. Такие эритроциты быстро разрушаются, возникает гемолитическая анемия. Последняя бывает только у гомозигот, у гетерозигот течение бессимптомное. [13]
Гематурия наблюдается при болезнях почек, а также при повреждениях моче-выводящих путей. Для обнаружения крови в моче пользуются пероксидазными свойствами гемоглобина, выражающимися в его способности катализировать окисление ряда веществ за счет перекиси водорода. В качестве окисляемых веществ используют бензидин и гваяковую смоляную кислоту. [14]
В основу спектроскопического ( и микроспектрального) анализа положено свойство гемоглобина и его производных поглощать волны света определенной длины. Поэтому при прохождении луча света через растворы, содержащие гемоглобин или его производные, в спектре появляются темные полосы поглощения, расположенные в определенной части спектра для каждого производного гемоглобина. [15]
Страницы: 1 2