Среднее значение - коэффициент - активность
Cтраница 1
Средние значения коэффициентов активности некоторых иодидов в воде при 208 16 К. Точки нанесены по опыт -, ным данным. [1]
Однако для упрощения вычислений везде используются средние значения коэффициентов активности. [2]
Однако для упрощения вычислений везде используют средние значения коэффициентов активности. [3]
Хотя для водных растворов существуют различные методы измерения средних значений коэффициентов активности электролитов и некоторых их комбинаций, коэффициент активности отдельного иона не доступен измерению. [4]
Это объясняется тем, что данные табл. 6 представляют собой средние значения коэффициентов активности, которые в действительности несколько различны для разных ионов. [5]
Для того чтобы найти по таблице ( см. Приложение VI) среднее значение коэффициента активности flt необходимо сначала вычислить величину ионной силы ц полученного раствора. В присутствии NaC2H3O2 уксусная кислота практически находится в недиссоциированном состоянии, поэтому ионную силу раствора можно определить по ацетату натрия. [6]
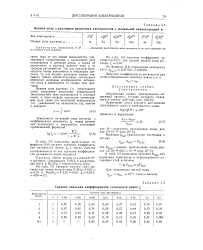 |
Ионная сила ц растворов различных электролитов с моляльной концентрацией м. [7] |
В табл. 3 - 3 приведены вычисленные по формуле ( 3 - 6) средние значения коэффициентов активности ионов / -, а также заметно отклоняющиеся от них значения коэффициентов активности ионов водорода. [8]
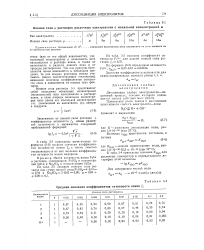 |
Ионная сила ц растворов различных электролитов с моляльной концентрацией м. [9] |
В табл. 3 - 3 приведены вычисленные по формуле ( 3 - 6) средние значения коэффициентов активности ионов f; а также заметно отклоняющиеся от них значения коэффициентов активности ионов водорода. [10]
Полученный результат отличается от найденного на опыте значения для ПРСа5О4, равного 6ЫО-5, вследствие того, что данные табл. 6 представляют собой средние значения коэффициентов активности, которые в действительности несколько различны у разных ионов. [11]
Полученный результат отличается от найденного на опыте значения для ГФсаЗО РЭВНОГО 6 1 - Ю-5, вследствие того, что данные табл. 6 представляют собой средние значения коэффициентов активности, которые в действительности несколько различны у разных ионов. [12]
Здесь и в дальнейшем индекс Res означает фазу смолы, m - молярную концентрацию в водном растворе, N - молярную долю в твердой фазе, i - среднее значение коэффициента активности в растворе, f А и / в - коэффициенты активности в твердой фазе, X - анион в водном растворе, А и В - вытесненные ионы. [13]
 |
Приближенное значение средних коэффициентов активности в зависимости от ионной силы раствора. [14] |
Из этой формулы следует, что чем больше ионная сила раствора, тем меньше коэффициент активности его ионов; если ионные силы двух растворов равны, то коэффициенты активности равновалентных ионов также одинаковы. В табл. 14 приведены средние значения коэффициентов активности ионов в зависимости от величины ионной силы раствора. [15]
Страницы: 1 2