Высокое значение - константа - скорость
Cтраница 1
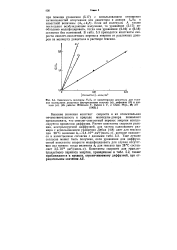
Высокие значения констант скорости и их относительная нечувствительность к природе молекулы-донора позволяют предположить, что синглет-синглетный перенос энергии контролируется процессом диффузии. [2]
Это высокое значение константы скорости реакции ( 130) согласуется с предположением об атаке гидроксильным радикалом по двойной 5 6-связи. С ростом рН & 1зо Для урацила монотонно растет без резких изменений вблизи р / С. [3]
Более серьезной аномалией являются высокие значения констант скорости 1012 и 1013 л-моль 1-сек 1, так как ни одна реакция не может протекать быстрее, чем столкновение при диффузии. Есть несколько возможных объяснений этого. [4]
Условием успешного проведения процесса является высокое значение константы скорости реакции. [5]
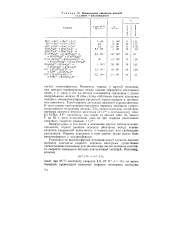 |
Кинетические параметры реакций окисления - восстановления. [6] |
Указанием на внешнесферный механизм может служить высокое значение константы скорости переноса электрона, существенно превосходящее возможное для данной пары частиц значение константы скорости замещения лиганда реагирующей частицей. [7]
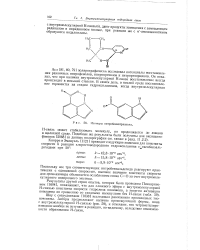 |
Изомеры нитробензотриазола. [8] |
Поскольку все три соответствующих нитробензальдегида реагируют практически с одинаковой скоростью, высокое значение константы скорости для о / 7 / яо-изомера объясняется ослаблением связи СО за счет внутримолекулярного водородного мостика. [9]
В приведенных реакциях отсутствует изменение ковалентных связей. Вследствие высоких значений констант скоростей этих реакций их называют очень быстрыми. [10]
Как известно, в горне доменной печи на воздушном и тем более на обогащенном кислородом дутье развиваются очень высокие температуры, порядка 1550 - 1800 С. Это обусловливает высокие значения констант скоростей реакции окисления, порядка k 600 - 1100 см / сек. [11]
Однако вследствие высоких значений констант скорости взаимодействия гид-ратированных электронов и атомов водорода с кислородом, гидроперекисный радикал весьма эффективно образуется в растворах, содержащих кислород. Поэтому радикал Н02 играет важную роль в радиолизе водных растворов. Возникновение гидроперекисного радикала доказано в настоя-шее время и прямыми методами. Шмидт [38] наблюдал в облученной воде, содержащей кислород, возрастание электропроводности, обусловленное присутствием 0 - ч щелочной формы гидроперекисного радикала. [12]
Что касается гомогенной химической реакции распада оксифторидных комплексов, то в литературе нет надежных данных, подтверждающих или опровергающих наличие этой стадии. Вероятно, это обусловлено высокими значениями константы скорости реакции и, следовательно, большими экспериментальными трудностями, а кроме того, является косвенным подтверждением того, что данная стадия не может лимитировать катодный процесс. [13]
Переход к более реакционноспособным диэфирам и, особенно, к диангидридам ароматических дикарбоновых кислот приводит к возможности снижения температуры полиамидирования. Более того, повышение температуры нежелательно из-за ускорения побочных реакций, снижающих ММ полимера. Высокие значения констант скоростей и равновесия реакций ацилирования ангидридами кислот сближают их по ряду деталей механизма с типично необратимыми процессами ацилирования полиаминов галогенангидридами. [14]
Реакция изучена в области давлений 0 003 - 600 тор. При Р 0 5 тора отмечена гетерогенная составлявшая. При Р 100 тор наблюдалось аномально высокое значение константы скорости. [15]
Страницы: 1 2