Данный золь
Cтраница 1
 |
Взаимная Koarv - г т - i 1 г -. т - tr - / ляция лиофобных коллоидот [ mAgl ] xAg [ nAgl ] yl - - [ ( m n - f. [1] |
Данный золь будет являться положительно заряженным. [2]
Коагуляцию золя возможно выянять прибавлением к нему геля, пептизацией которого был получен данный золь. [3]
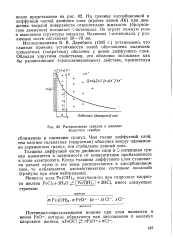 |
Распределение зарядов в мицелле йодистого серебра. [4] |
Чем толще диффузный слой, тем плотнее сольватная ( гидратная) оболочка вокруг одноименно заряженных гранул, тем стабильнее данный золь. [5]
Факторы коагуляции лиофобных золей весьма разнообразны: коагуляция может быть вызвана повышением температуры, разного рода механическими воздействиями ( встряхиванием, взбалтыванием), высокочастотными колебаниями, ультрацентрифугированием, повышением концентрации, введением в золь посторонних веществ, ссобенно электролитов, действием на данный золь других золей и другими причинами. Действие таких факторов, как температура, концентрирование, механические воздействия, вполне понятно, поскольку все они способствуют сближению частиц, преодолению сил отталкивания между ними и, следовательно, слипанию их; однако в большинстве случаев действие этих факторов незначительно. [6]
Значения О различных золей имеют порядок 10 - 5 смг / с, что в 102 - 104 раз меньше тех же значений, характерных для молекул и ионов. Данный золь характеризуется некоторым средним значением О, с изменением размеров его частиц изменяется и коэффициент диффузии золя. [7]
Золь серы был получен путем добавления 5 мл раствора серы в спирте к 10 см3 дистиллированной воды. Каким методом получен данный золь. Чем объясняется, что в проходящем свете золь обладает красновато-оранжевым оттенком, а в отраженном - голубым. [8]
Золь серы был получен добавлением 5 см. раствора серы в спирте к 10 см3 дистиллированной воды. Каким методом получен данный золь. Чем объясняется, что в проходящем свете золь обладает красновато-оранжевым оттенком, а в отраженном - голубым. [9]
Факторы коагуляции коллоидных систем бывают весьма разнообразными. Коагуляция может быть вызвана повышением температуры, длительным диализом, добавлением электролитов, разного рода механическими воздействиями ( размешиванием, встряхиванием, взбалтыванием), сильным охлаждением, ультрацентрифугированием, концентрированием, пропусканием электрического тока, а также действием на данный золь других золей. Поскольку главное условие уменьшения устойчивости коллоидных растворов - потеря электрического заряда, основными методами их коагулирования являются методы снятия зарядов. Чаще всего в практике для этой цели пользуются воздействием на коллоидные растворы различных электролитов. [10]
Факторы коагуляции коллоидных систем бывают весьма разнообразными. Коагуляция может быть вызвана повышением температуры, длительным диализом, добавлением электролитов, разного рода механическими воздействиями ( размешиванием, встряхиванием, взбалтыванием), сильным охлаждением, ультрацентрифугированием, концентрированием, пропусканием электрического тока, а также действием на данный золь других золей. Поскольку главное условие уменьшения устойчивости коллоидных растворов - потеря электрического заряда, основными методами их коагулирования являются методы снятия зарядов. Чаще всего в практике для этой цели пользуются воздействием на коллоидные растворы различных электролитов. [11]
Факторы коагуляции коллоидных систем могут быть весьма разнообразными. Так, например, коагуляция может быть вызвана повышением температуры, длительным диализом, добавлением электролитов, разного рода механическими воздействиями ( размешиванием, встряхиванием, взбалтыванием), сильным охлаждением, ультрацентрифугированием, концентрированием, пропусканием электрического тока, а также действием на данный золь других золей. [12]
Дерягина ( 1945) установлено, что устойчивость золей обусловлена, главным образом, наличием сольватных ( гидратных) оболочек у ионов диффузного слоя. Обладая упругими свойствами, эти оболочки оказывают как бы раздвигающее ( расклинивающее) действие, препятствуя сближению и слипанию гранул. Чем толще диффузный слой, тем плотнее соль-ватная ( гидратная) оболочка вокруг одноименно заряженных гранул и стабильнее данный золь. [13]
По современным представлениям основная причина устойчивости зол ей обусловлена наличием сольватных ( гидратных) оболочек у ионов диффузного слоя. Обладая упругими свойствами, эти оболочки препятствуют слипанию частиц. Чем толще диффузный слой, тем плотнее сольватная ( гидратная) оболочка вокруг одноименно заряженных частиц, тем выше - потенциал частиц и тем стабильнее данный золь. В настоящее время для получения коллоидных растворов используют два принципиально различных метода - дисперсионный, основанный на раздроблении грубодисперсного вещества до размеров коллоидных частиц, и конденсационный, в основе которого лежит конденсация ( укрупнение) частиц за счет слипания атомов или молекул вещества. При получении золей как первым, так и вторым способами вещество дисперсной фазы должно быть практически не растворимым в дисперсионной среде. [14]
Коллоидные системы довольно стабильны, в них действуют силы, препятствующие укрупнению мицелл. Переход золя в гель называется коагуляцией. Коагуляция ( осаждение) - процесс укрупнения мицелл, происходящий под действием броуновского движения; она может быть вызвана повышением температуры или концентрации, разного рода механическими воздействиями, введением в данный золь других золей. Время ( скорость) коагуляции может быть различным - от долей секунды, когда образование геля проходит практически моментально, до многих дней и недель. Скорость коагуляции определяет строения геля. [15]
Страницы: 1