Взаимодействие - газообразный аммиак
Cтраница 1
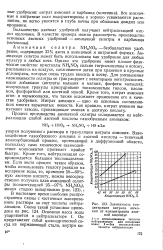 |
Зависимость концентрации нитрата аммония от концентрации азотной кислоты. [1] |
Взаимодействие газообразного аммиака и азотной кислоты - типичный хемосорбционный процесс, протекающий в диффузионной области, поскольку само химическое взаимодействие компонентов протекает крайне быстро. Кроме того, нейтрализация сопровождается большим тепловыделением. В настоящее время наиболее распространены схемы с частичным выпариванием раствора за счет теплоты нейтрализации. [2]
Рассмотрим взаимодействие газообразного аммиака с водным раствором соли никеля. Взаимодействие этого аквакомплекса с аммиаком происходит в шесть стадий, каждая из которых представляет собой обратимую реакцию и характеризуется собственной константой равновесия. Константы равновесия каждой из стадий образования комплексной частицы называются частными константами устойчивости. [3]
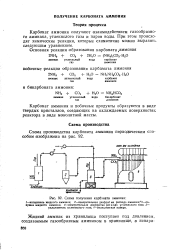 |
Схема получения карбоната аммония. [4] |
Карбонат аммония получают взаимодействием газообразного аммиака, углекислого газа и паров воды. При этом происходят химические реакции, которые схематично можно выразить следующим уравнением. [5]
Например, при взаимодействии газообразного аммиака с жидким азотом аммиак переходит вначале в жидкое, а затем в твердое состояние. Это не химическое, а физическое явление, так как состав веществ ( и азота и аммиака) не меняется. Некоторые явления, приводящие к образованию новых веществ, относятся к физическим. Таковы, например, ядерные реакции ( см. § 2.3), в результате которых из атомов одних элементов образуются атомы других. Такие явления изучает ядерная физика. [6]
Какие химические вещества образуются при взаимодействии газообразного аммиака, углекислого газа и воды. [7]
Получение растворов аммиачной селитры основано на взаимодействии газообразного аммиака и азотной кислоты. [8]
Соли аммония могут быть получены не только взаимодействием газообразного аммиака с кислотами, но и водных растворов аммиака с кислотами. [9]
В патентах [15, 16] описывается процесс кристаллизации сульфата аммония в результате взаимодействия газообразного аммиака и двуокиси углерода в растворе сульфата аммония с получением смешанного раствора сульфата и карбоната аммония. [10]
Получают его насыщением аммиачной воды углекислотой с последующей отгонкой карбоната аммония при температуре 70 - 80 или в результате взаимодействия газообразного аммиака и двуокиси углерода в присутствии паров воды. Карбонат аммония очень нестоек. На открытом воздухе он разлагается с выделением аммиака и переходит в бикарбонат аммония. Технический продукт содержит 21 - 24 % азота и представляет смесь карбоната аммония ( NH4) 2C03, бикарбоната аммония NH4HC03 и карбамата аммония. [11]
 |
Влияние различных форм азотных удобрений на урожай и сахаристость корней сахарной свеклы. / - NaN03. / / - NH4N03. / / / - ( NH4 2S04. IV - NH4C1. [12] |
Получают его насыщением аммиачной воды углекислотой с последующей отгонкой карбоната аммония при температуре 70 - 80 или в результате взаимодействия газообразного аммиака и двуокиси углерода в присутствии паров воды. Карбонат аммония очень нестоек. На открытом воздухе он разлагается с выделением аммиака и переходит в бикарбонат аммония. Технический продукт содержит 21 - 24 % азота и представляет смесь карбоната аммония [ ( NH4) 2C031, бикарбоната аммония ( NH4HC03) и карбамата. [13]
Раствор аммиака, или нашатырный спирт, NH4OH ( Solutio ammonii caustici или Liquor ammonii caustici), молекулярная масса 35 05, представляющий собой водный раствор продукта взаимодействия газообразного аммиака с водой. [14]
Химические процессы, приводящие к образованию аэрозолей, весьма разнообразны, но сущность их заключается в том, что газообразные вещества в результате реакции дают твердые или жидкие продукты, обладающие весьма малой упругостью пара - Классическим примером может служить дым хлористого аммония, возникающий при взаимодействии газообразного аммиака и хлористого водорода, или дым окиси магния, возникающий при сгорании магния. [15]
Страницы: 1 2