Взаимодействие - ионит
Cтраница 1
Взаимодействие ионита с растворителем, содержащим органические ионы, сопровождается выделением дополнительной энергии при адсорбции этих ионов за счет сил молекулярной адсорбции. [1]
Взаимодействие ионита с растворителем, содержашим органические ионы, сопровождается выделением дополнительной энергии при адсорбции этих ионов за счет сил молекулярной адсорбции. [2]
Некоторые особенности взаимодействия индивидуальных ионитов и газов, а также количественные характеристики ряда процессов рассматриваются ниже. [3]
Практически важным является взаимодействие ионитов и электролитов раствора, когда удаление ионов сопровождается образованием осадка труднорастворимого вещества. Механизм такого взаимодействия для случая одного ионита состоит в том, что выделяемый ионитом противоион образует в растворе труднорастворимое соединение с одним или несколькими ионами другого знака заряда. Ионит в таких реакциях играет роль носителя ионов-оса-дителей и обладает тем преимуществом перед обычными химическими реагентами, что в систему не вводятся какие-либо дополнительные ионы. Аналогично растворению труднорастворимых веществ осадок в растворе может образовываться как при раздельном применении катионита или анионита, так и при их совместном использовании в соответственно подобранных ионных формах. Именно противоионы таких катионита и анионита образуют труднорастворимое вещество. [4]
Гидрофильные активные группы ионитов способствуют взаимодействию ионита с водой. Если таких групп много, а сетка слаба ( мало поперечных связей), зерно ионита разрушается - смола целиком переходит в состояние истинного раствора. Поверхность раздела ионит - жидкая фаза исчезает, и смола теряет свою способность быть ионообменником. [5]
Процесс ионообменной адсорбции зависит от сил взаимодействия ионита с ионами, концентрации обменивающегося иона, размеров обменивающихся ионов, возможности проникновения ионов в зерна ионита, свойств растворителя. На процессы ионного обмена влияют радиусы ионов, их объем и гидратация. Например, при малых концентрациях ионов в растворе при обычной температуре полнота обмена ионов возрастает с. [6]
Для теории ионного обмена существенный интерес представ - 1яет изучение термодинамических функций взаимодействия ионита: чистым растворителем или с его парами. [7]
Применение отдельных ионитов сводится в основном к двум способам: 1) статическому, когда взаимодействие ионита происходит одновременно со всем объемом раствора, и 2) динамическому, который осуществляется в колонке путем фильтрования исходного раствора через неподвижный слой ионообменного материала. [8]
Кроме прямого эффекта радиации, на радиационную стабильность ионитов большое влияние оказывают косвенные эффекты радиации, связанные со взаимодействием ионита с продуктами радио-лиза жидкой фазы. В частности, большую роль играет сольватная оболочка. Увеличение набухаемости ионита приводит к растяжению полимерной сетки и к ослаблению межмолекулярных и внутримолекулярных связей в ионите. [9]
Индексы ( 1) или ( 2) ставят у тех компонентов, которые десорбируются ши сорбируются при взаимодействии ионита с раствором. [10]
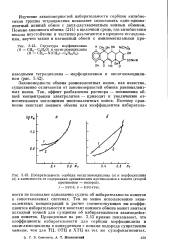 |
Избирательность сорбции оксиглюкоциклина ( а и морфоциклина ( б в зависимости от содержания органических противоионов в ионите ( второй. [11] |
Тем не менее использование эквивалентных концентраций и расчет соответствующих им коэффициентов избирательности и констант ионного обмена может явиться исходной точкой для суждения об избирательности взаимодействия ионитов. Приведенные на рис. 3.43 кривые показывают, что коэффициенты избирательности для сорбции морфоциклина и оксиглюкоциклина в конкуренции с ионами водорода существенно меньше, чем для ТЦ, ОТЦ и ХТЦ на тех же сульфокатионитах. [12]
Таким образом, при уменьшении емкости, хотя значения параметров изотермы БЭТ близки к значениям для ионитов с полной емкостью, зависимость их от состава твердой фазы меняется и катионит КУ-2 ( 3), в смысле взаимодействия ионита с водой, более энергетически равноценен, чем катионит КУ-2 ( 1), что, возможно, связано с увеличением расстояния между фиксированными ионами и уменьшением влияния их друг на друга. [13]
Доннановское исключение электролита ослабевает с ростом концентрации раствора. Поэтому взаимодействие ионитов с концентрированными растворами электролитов не ограничивается эквивалентным обменом ионов; одновременно происходит также неионообменная сорбция электролита, которая становится важным фактором при рассмотрении явлений селективности ионитов в концентрированных средах. [14]
 |
Непрерывно действующий ионообменный аппарат с движущимся слоем ионита. [15] |
Страницы: 1 2