Взаимодействие - атом - натрий
Cтраница 1
Взаимодействие атомов натрия и хлора в соответствии с теорией ионной Связи сопровождается переносом электрона от натрия к хлору. Известно, что на внешнем уровне щелочные металлы содержат по одному 5-электрону. У них на один электрон больше, чем у атомов предшествующих благородных газов. Поскольку щелочные металлы характеризуются малой энергией ионизации, они легче всего образуют катионы. Аналогично ведут себя и щелочно-земельные металлы. Это значит, что до восьмиэлектронной оболочки у галогенов не хватает по одному электрону. [1]
Сопоставим взаимодействие атома натрия с атомом хлора с взаимодействием иона натрия и иона хлора. Потенциал ионизации натрия равен 5 14 эв, а сродство хлора к электрону - 3 72 эв. Поэтому, если два атома находятся на бесконечно большом расстоянии один от другого, система Na ( газ) С1 ( газ) более устойчива, чем система Na ( г-аз) СГ ( газ) на 5 14 - - - 3 72 1 42 эв. С другой стороны, если два иона находятся не на бесконечном расстоянии, а на некотором расстоянии г один от другого, то их взаимодействие приводит к стабилизации системы на величину кулоновской энергии е 2 / г. Если г измеряется в ангстремах, эта энергия равна 14 42 / г эв. Поскольку неионизированные атомы, по-видимому, не взаимодействуют заметно до тех пор, пока они не сближаются на расстояния меньше 5 - 6 А ( когда они начинают притягиваться благодаря образованию ковалентной связи), кривые потенциальной энергии двух систем должны пересекаться. На расстоянии меньше 10 А ионизированное состояние должно быть более стабильным, чем неионизированное. При очень малых межионных расстояниях орбиты электронов остова начинают перекрываться, вызывая отталкивание, так что энергия пары ионов проходит через минимум. Поскольку равновесное межионное расстояние в кристаллическом NaCl равно 2 81 А, мы можем ожидать, что минимум энергии пары ионов находится примерно на таком же расстоянии. [2]
При взаимодействии атомов натрия с парами органических галогенидов только часть двойных столкновений приводит к химическим реакциям. [3]
При взаимодействии атомов натрия и фтора атомы натрия отдают электрон атому фтора. При этом образуются ионы натрия и фтора, которые притягиваются друг к другу, в результате получается кристаллическое ионное соединение, называемое фторидом натрия. Связь, которая удерживает ионы вместе, принято называть ионной связью. Такие соединения чаще всего образуются при взаимодействии металлов с неметаллами, поскольку металлы легко теряют электроны, а неметаллы их приобретают. [4]
Рассмотрим механизм образования ионной связи. При взаимодействии атомов натрия ( Is22s22p63s) с атомами хлора ( Is22s22p63s23p6) происходит переход электрона с Зз-орбитали атома натрия на Зр-ор-биталь атома хлора. Атом же хлора принимает этот электрон на Зр-орбиталь, превращаясь в отрицательно заряженный ион с электронной конфигурацией Is22s22pe3s23p6, характерной для аргона. Образовавшиеся в результате перехода электронов противоположно заряженные ионы натрия и хлора прочно удерживаются силами электростатического притяжения. [5]
Рассмотрим механизм образования ионной связи. При взаимодействии атомов натрия ( Is22s22p63s) с атомами хлора ( Is22s22p63s23p5) происходит переход электрона с Зз-орбитали атома натрия на Зр-ор-биталь атома хлора. Атом же хлора принимает этот электрон на Зр-орбиталь, превращаясь в отрицательно заряженный ион с электронной конфигурацией Is22s22p63s23p6, характерной для аргона. Образовавшиеся в результате перехода электронов противоположно заряженные ионы натрия и хлора прочно удерживаются силами электростатического притяжения. [6]
Согласно атомно-молекулярному учению молекулы состоят из атомов, но это не означает, что химические свойства молекулы являются простой суммой химических свойств образующих ее атомов. Так, при взаимодействии атомов натрия с атомами хлора образуются частицы хлористого натрия, химические свойства которых резко отличаются от химических свойств атомов натрия и хлора. Это означает, что в процессе образования молекулы атомы изменяются. [7]
По данным одного исследователя [35 ] присоединение молекул кислорода к органическим свободным радикалам протекает с исключительной легкостью; так, энергию активации для взаимодействия этиллинолеатногб радикала с кислородом можно принять равной нулю. Следует подчеркнуть, что даже для взаимодействия атома натрия с кислородом [18] требуется, правда весьма незначительная, энергия активации. Высказано предположение [152], что при жидкофазном окислении тетра лина взаимодействие радикалов с кислородом происходит легко и с малой энергией активации. Отсюда можно сделать вывод, что органические радикалы взаимодействуют с кислородом с энергией активации, близкой к нулю, и реакции по уравнениям ( 107) и ( 108) протекают чрезвычайно легко. [8]
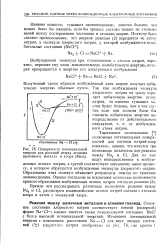 |
Поверхности потенциальной энергии для реакций между атомами щелочного металла и хлора ( Меги. [9] |
Образование этих молекул объясняет результаты опытов по тушению люминесценции. Прежде чем рассматривать различные возможные реакции между Na2 и С1, рассмотрим взаимодействие атомов натрия сначала с атомами хлора и затем с молекулой хлора. [10]
 |
Расположение шести ионов Na вокруг. [11] |
Различие в электроотрицательности взаимодействующих атомов приводит к образованию полярной связи вследствие смещения электронной плотности молекулярной орбитали к более электроотрицательному атому. Если же различие между атомами очень велико, то можно говорить о полном переходе электронной пары к более электроотрицательному атому. Упрощенно это сводится к переходу электрона от одного атома к другому, например при образовании хлорида натрия NaCl. Взаимодействие атомов натрия и хлора в соответствии с теорией ионной связи сопровождается переносом электрона от натрия к хлору. [12]
Ионные кристаллические решетки строятся по другому принципу. В этом случае кристалл образуется вследствие взаимного электростатического притяжения ионов, имеющих заряды различных знаков. Например, поваренная соль ( хлористый натрий) состоит из ионов натрия и хлора. Атом натрия легко теряет свой единственный валентный электрон и становится однозарядным положительным ионом. Хлор имеет семь валентных электронов и поэтому свободно присоединяет один электрон, при этом становится однозарядным отрицательным ионом. При взаимодействии атомов натрия и хлора происходит их взаимная ионизация, после чего начинают действовать электростатические силы притяжения - образуется кристаллическая решетка, состоящая из ионов натрия и хлора. Эти ионы располагаются в кристалле в определенном порядке и на определенных расстояниях, так как увеличению расстояния между ними мешают силы притяжения, а уменьшать расстояние не позволяют силы отталкивания, возникающие при чрезмерном сближении между электронами внешних слоев сближающихся ионов. Очевидно, что в таком кристаллическом теле не может быть значительного количества свободных электронов, так как все валентные электроны связаны с ионами кристаллической решетки. [13]
Страницы: 1