Взаимодействие - разнородная молекула
Cтраница 3
Теоретически обоснованной формой уравнения состояния для умеренно сжатых газообразных смесей является, как известно, вириальная форма. Однако практическое использование вириального уравнения невозможно из-за отсутствия значений вириалышх коэффициентов взаимодействия разнородных молекул. Следует заметить, что очень большие трудности, возникающие при вычислении старших вириальных коэффициентов уравнения состояния чистых газов, в значительной мере усугубляются в случае смесей в связи с необходимостью учета различий в межмолекулярном взаимодействии разных пар группы взаимодействующих частиц. [31]
Часто идеальные смеси определяют как смеси, компоненты которых подчиняются закону Рауля. Из изложенного выше вытекает, что подчинение закону Рауля является следствием идентичности взаимодействия однородных и разнородных молекул компонентов. Основанное на этом понятие об идеальной смеси является более широким и применимо к любым смесям, находящимся в конденсированном состоянии. [32]
В смеси реальных газов взаимодействуют однородные молекулы индивидуальных веществ и разнородные молекулы компонентов смеси. Условия, определяющие подобие смеси и ее компонентов, могут быть распространены на взаимодействие разнородных молекул. [33]
В бесконечно разбавленных растворах молекулы растворенного вещества в среднем находятся столь далеко друг от друга, что в ближайшем окружении каждой такой молекулы находятся только молекулы растворителя. Поэтому средняя потенциальная энергия молекул растворенного вещества в таких растворах зависит только от взаимодействия разнородных молекул, а молекул растворителя - только от взаимодействия однородных молекул. [34]
С увеличением количества и степени упорядоченности надмолекулярных образований возрастает энергия, которая должна быть затрачена на их разрушение. Поэтому при совмещении полимеров для достижения положительного теплового эффекта смешения необходимо, чтобы энергия, выделяющаяся вследствие взаимодействия разнородных молекул, превосходила энергию их собственного взаимодействия в неупорядоченном состоянии и энергию образования соответствующих кристаллических и других высокоорганизованных структур. Такие системы очень редки. [35]
В системах, содержащих менее 60 % ППС ( например, кривые 3 - 5), параметры релаксации дипольной поляризации зависят от количественного состава, что указывает на образование переходных слоев и значительный вклад взаимодействий разнородных молекул. По мере снижения содержания ППС процессы с характеристиками, свойственными гомофазному ППС, исчезают, морфология композиции становится более однородной. [36]
Принципы, позволяющие прогнозировать растворимость вещества, разработаны еще недостаточно строго. Растворимость определяется физическим и химическим сродством молекул растворителя и растворяемого вещества, соотношением энергий взаимодей-ствия однородаых и разнородных компонентов раствора, характеризуемым, например, с помощью так называемой, энергии взаимообмена. Если преобладает взаимодействие разнородных молекул ( ш 0), растворимость относительно велика, а часто и неограниченна; если преобладает взаимодействие одинаковых молекул ( ю 0), растворимость обычно невелика. [37]
В зависимости от того, как меняются те или иные термодинамические функции при образовании раствора, растворы полимеров делятся на идеальные и реальные. Образование идеального раствора происходит без изменения энтальпии; АЯ0, изменение энтропии при смешении ASCM - RlnNi, где N - мольная доля растворенного вещества. В этом случае энергии взаимодействия однородных и разнородных молекул близки. [38]
Образование идеального раствора происходит без изменения энтальпии; ДЯ 0, изменение энтропии при смешении Д5щ - KlnN где N - мольная доля растворенного вещества. Идеальные растворы образуются при смешении веществ, близких по своему химическому строению и размерам молекул. В этом случае энергии взаимодействия однородных и разнородных молекул близки. [39]
Уравнения ( VII, 50) и ( VII, 51) служат для термодинамического определе-ия понятия регулярный раствор. Еслн величина Q в уравнении ( VII, 47) невелика, то можно предположить, что различие в энергиях взаимодействия однородных и разнородных молекул в растворе невелико и не сказывается на пространственном распространении молекул компонентов в растворе, которое остается хаотическим. [40]
Уравнения ( VII, 50) и ( VII, 51) служат для термодинамического определения понятия регулярный раствор. Если величина Q в уравнении ( VII, 47) невелика, то можно предположить, что различие в энергиях взаимодействия однородных и разнородных молекул в растворе невелико и не сказывается на пространственном распространении молекул компонентов в растворе, которое остается хаотическим. [41]
Структура полимера или его раствора в критической области пока не выяснена, здесь можно высказать лишь некоторые предположения. Вполне возможно, что в этой области происходит такое сжатие макромолекулярных клубков или упорядочение надмолекулярных структур, которое может обеспечить значительное снижение вязкости, на возможность такой перестройки указывает и работа Эскина [204], рассчитавшего, что в критической точке размеры макромолекулярных клубков в 1 5 - 7 раз меньше, чем в 0-точке. Это отрицательное взаимодействие затем, после расслаивания, резко уменьшается, потому что одинаковые молекулы образуют частицы ( обычно капли) другой фазы и взаимодействие разнородных молекул осуществляется только по сравнительно ограниченной поверхности раздела фаз. [42]
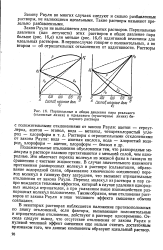 |
Парциальные и общее давления пара реального ( сплошные линии и идеального ( пунктирные линии бинарного раствора. [43] |
Положительные отклонения обусловлены тем, что разнородные молекулы в растворе взаимно притягиваются с меньшей силой, чем однородные. Это облегчает переход молекул из жидкой фазы в газовую по сравнению с чистыми жидкостями. В случае значительного взаимного притяжения разнородных молекул в растворе ( сольватация, образование водородной связи, образование химического соединения) переход молекул в газовую фазу затруднен, что вызывает отрицательные отклонения от закона Рауля. Переход молекул из раствора в пар со-про вождается тепловым эффектом, который в случае удаления однородных молекул отрицателен, а при указанном выше взаимодействии разнородных молекул положителен. Таким образом, знак отклонения растворов от закона Рауля и знак теплового эффекта смешения обычно совпадают. [44]
Страницы: 1 2 3