Взаимодействие - нитрогруппа
Cтраница 1
Взаимодействие нитрогруппы с карбоксильными группами, как наблюдалось, сводит к нулю все изменения в спектре после протонирования. Так, например, найдено, что ни / г-нитробензойная кислота [113], ни / г-нитро-бензамид [100] нельзя изучать как слабые основания по методу индикаторов Гаммета. [1]
 |
Ультрафиолетовые спектры поглощения нитроалкенов. [2] |
Этиленовые остатки не нарушают взаимодействия нитрогрупп с ароматическим кольцом: положение длинноволновой полосы поглощения в ряде арилнитроалкенов по сравнению с нитробензолом и соответствующими его производными смещено в видимую область. [3]
В случае нитробензола следует учитывать еще и взаимодействие нитрогруппы с я-электрон-ной системой. [4]
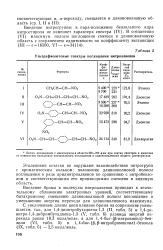
Суля по некоторым химическим свойствам а-галогенполикитроалканов [172], основной эффект взаимодействия нитрогрупп с атомом галогена проявляется на связи С-Hal. Галоген становится более положительным. Результаты квантово-химических расчетов согласуются с такой точкой зрения. [5]
Поскольку только энергия, соответствующая вакантной орбитали, близка к энергии МО бензольного кольца, взаимодействие нитрогруппы с кольцом лучше представлять моделью возмущенного бензильного катиона, а не возмущенного 2-феншшропенила. Подобные соображения оправдывают использование модели бензильного катиона в трактовке карбонильной группы. [6]
 |
Дипольные моменты а-галоген-1 1-динитроалканов.| Дипольные моменты галогеяпроизводных. [7] |
Таким образом, судя по данным табл. 45 и 50, можно считать, что взаимодействие нитрогрупп с атомом галогена приводит к сильным изменениям электронной оболочки молекул. [8]
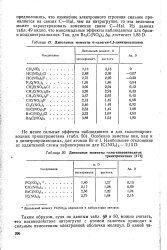
В 1 3 5-тринитробензоле эффект замещения водорода нитрогруппой составляет 532 5 [70] и 540 6 ккал / моль [68, 69], что соответствует энергии взаимодействия нитрогрупп в 21 9 или 13 8 ккал / моль. Из величины 13 8 ккал / моль получается энергия парного взаимодействия 4 6 ккал / моль, близкая к числу 4 8 ккал / моль. Такой анализ помогает сделать заключение о надежности экспериментальных данных различных авторов. [9]
Это по-прежнему для величины ДР3 ( 1) дает несколько завышенное значение 191 0, которое также приводит к физически необоснованному увеличению взаимодействия между нитрогруппами в положении 1 2 по сравнению с взаимодействием нитрогрупп в положении 1 1 в соединениях 2 3-диметил - 2 3-динитробутан и 2 3 3-тринитро - 2-метилпентан. Выбрав в качестве следующего приближения величины ДР. [10]
Имеются две общие характеристики указанных выше групп: они представляют собой ненасыщенные электроноакцепторные функции; и все они нелинейны. Существует ряд объяснений этого явления ориентации, которые целиком основаны па первой, а именно па электронной характеристике. Брэнч и Кельвин [31] высказали предположение, что атака, направленная в opmo - положение, в меньшей степени мешает обычному взаимодействию нитрогруппы с кольцом, чем атака, направленная в иара-положение. [11]
В табл. 13 ( а, б, в, г) представлены энергии взаимодействия Ад ( т) приходящиеся на пару нитрогрупп, принадлежащих различным атомам углерода, и общая энергия отталкивания между такими нитрогруппами в рассматриваемой молекуле. Индекс k указывает на число связей С-С, разделяющих взаимодействующие нитрогруппы, а индексы т и п - на число нитрогрупп, расположенных у концевых углеродных атомов. Из табл. 13 ( а, б, в, г) видно, что энергия взаимодействия как для жидкого, так и для газообразного состояния практически совпадают, что указывает на существенно внутримолекулярный характер взаимодействия нитрогрупп. Как видно из табл. 13а энергии взаимодействия нитрогрупп в положении 1 2 не являются строго аддитивными. Интересно отметить, что с увеличением общей энергии отталкивания энергия отталкивания между парой взаимодействующих нитрогрупп уменьшается от Г 2-динитроэтана и 2 3-динитро - 2 3-ди-метилбутана к гексанитроэтану. Вероятно, снижение энергии парных взаимодействий в полинитросоединениях обусловлено изменением геометрических параметров молекул, изменением длин С-С - и С-N - связей. Экспериментальные данные для соединений, в которых имеются взаимодействия нитрогрупп в положении 1 2, относятся к наиболее надежным, и закономерное снижение энергии парного 1 2-взаимодействия заметно как в газовой, так и в жидкой фазе, где ошибки измерения и расчета снижаются. Исключение составляет только значение энергии 1 2-взаимодействия, полученное из 2 3 3-тринитро - 2-метилпентана, для которого имеется величина из работы Миллера и Ханта [65], выполненной на невысоком экспериментальном уровне. [12]
В табл. 13 ( а, б, в, г) представлены энергии взаимодействия Ад ( т) приходящиеся на пару нитрогрупп, принадлежащих различным атомам углерода, и общая энергия отталкивания между такими нитрогруппами в рассматриваемой молекуле. Индекс k указывает на число связей С-С, разделяющих взаимодействующие нитрогруппы, а индексы т и п - на число нитрогрупп, расположенных у концевых углеродных атомов. Из табл. 13 ( а, б, в, г) видно, что энергия взаимодействия как для жидкого, так и для газообразного состояния практически совпадают, что указывает на существенно внутримолекулярный характер взаимодействия нитрогрупп. Как видно из табл. 13а энергии взаимодействия нитрогрупп в положении 1 2 не являются строго аддитивными. Интересно отметить, что с увеличением общей энергии отталкивания энергия отталкивания между парой взаимодействующих нитрогрупп уменьшается от Г 2-динитроэтана и 2 3-динитро - 2 3-ди-метилбутана к гексанитроэтану. Вероятно, снижение энергии парных взаимодействий в полинитросоединениях обусловлено изменением геометрических параметров молекул, изменением длин С-С - и С-N - связей. Экспериментальные данные для соединений, в которых имеются взаимодействия нитрогрупп в положении 1 2, относятся к наиболее надежным, и закономерное снижение энергии парного 1 2-взаимодействия заметно как в газовой, так и в жидкой фазе, где ошибки измерения и расчета снижаются. Исключение составляет только значение энергии 1 2-взаимодействия, полученное из 2 3 3-тринитро - 2-метилпентана, для которого имеется величина из работы Миллера и Ханта [65], выполненной на невысоком экспериментальном уровне. [13]
Тогда дополнительная поляризация В по сравнению с В по существу заключается в отрицательном заряде карбоксилат-иона. Это сильно сказывается на общей энергии, во-первых, вследствие ориентации постоянных диполей воды и их притяжения и, во-вторых, благодаря индуцированию дополнительных диполей в органических остатках и в ближайших молекулах воды. При этом возникает также большой энтропийный эффект главным образом благодаря тому, что положения ближайших молекул воды становятся более фиксированными, что уменьшает статистическую вероятность нахождения иона в сольватированном состоянии. Предположим, что величины этих энергетических и энтропийных эффектов для первой и второй реакции не сильно отличаются друг от друга. Можно допустить, например, что поле диполя нитрогруппы мало влияет на силу притяжения или устойчивость положения тех молекул воды, которые находятся ближе всего к карбокси-лат-иону и поэтому оказывают определяющее влияние на энергию и энтропию сольватировапного иона. Это допущение можно также легко подвергнуть критике для энергетических и энтропийных эффектов, возникающих при взаимодействии нитрогруппы с ее ближайшим окружением. В этом случае высказанным предположениям можно придать другую эквивалентную форму, а именно: влияние заместителей в исходных соединениях сохраняется неизменным в конечных продуктах реакции. Но, помимо всех этих эффектов, которые по предположению взаимно уничтожаются в разностях разностей энергий и в разностях разностей энтропии начальных и конечных продуктов с заместителем и без него, остается некомпенсированное внутреннее взаимодействие двух дополнительных полярных связей, совместно присутствующих в ионе n - нитробензойной кислоты. Это должно вызвать остаточный энергетический эффект. В такой молекуле, где взаимодействующие центры отделены друг от друга и имеется лишь небольшая возможность стереохимической деформации, взаимодействие не может вызвать большого остаточного энтропийного эффекта. [14]
В табл. 13 ( а, б, в, г) представлены энергии взаимодействия Ад ( т) приходящиеся на пару нитрогрупп, принадлежащих различным атомам углерода, и общая энергия отталкивания между такими нитрогруппами в рассматриваемой молекуле. Индекс k указывает на число связей С-С, разделяющих взаимодействующие нитрогруппы, а индексы т и п - на число нитрогрупп, расположенных у концевых углеродных атомов. Из табл. 13 ( а, б, в, г) видно, что энергия взаимодействия как для жидкого, так и для газообразного состояния практически совпадают, что указывает на существенно внутримолекулярный характер взаимодействия нитрогрупп. Как видно из табл. 13а энергии взаимодействия нитрогрупп в положении 1 2 не являются строго аддитивными. Интересно отметить, что с увеличением общей энергии отталкивания энергия отталкивания между парой взаимодействующих нитрогрупп уменьшается от Г 2-динитроэтана и 2 3-динитро - 2 3-ди-метилбутана к гексанитроэтану. Вероятно, снижение энергии парных взаимодействий в полинитросоединениях обусловлено изменением геометрических параметров молекул, изменением длин С-С - и С-N - связей. Экспериментальные данные для соединений, в которых имеются взаимодействия нитрогрупп в положении 1 2, относятся к наиболее надежным, и закономерное снижение энергии парного 1 2-взаимодействия заметно как в газовой, так и в жидкой фазе, где ошибки измерения и расчета снижаются. Исключение составляет только значение энергии 1 2-взаимодействия, полученное из 2 3 3-тринитро - 2-метилпентана, для которого имеется величина из работы Миллера и Ханта [65], выполненной на невысоком экспериментальном уровне. [15]
Страницы: 1