Взаимодействие - бериллий
Cтраница 1
 |
Лншроструктура шва при пайке. [1] |
Взаимодействие бериллия с углеродом приводит к образованию карбида бериллия, имеющего высокую твердость. [2]
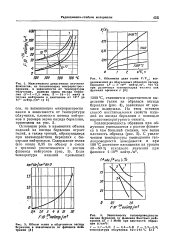
Взаимодействие бериллия с азотом начинается при температуре около 750 С и становится существенным при 850 С. Реакция с кислородом протекает более оживленно, и при 900 С окисление в кислороде происходит примерно вдвое быстрее, чем образование нитрида в азоте. Таким образом, при прогреве бериллия на воздухе нитрид составляет лишь малую долю всей возникшей окалины - примерно 0 75 % через 1 ч при 1000 С. [3]
Реакции взаимодействия бериллия с окислами углерода при 500 - 750 С и давлении 100 мм рт. ст. изучали Грегг, Хасси и Джепсон: [867] с помощью радиоактивного углерода-14. Реакция с двуокисью углерода придает защитную способность. [4]
Начало взаимодействия бериллия с азотом ( в виде цветов побежалости) обнаруживается при 725 С, при температурах 900 С начинается образование нитрида бериллия, которое, однако, очень медленно протекает даже при 1100 С. С аммиаком реакция проходит гораздо быстрее при тех же и даже более низких температурах. С водородом бериллий непосредственно не соединяется. Гидрид ( BeH2) x получен при разложении бериллий-органических соединений в виде твердого раствора, разлагающегося выше 200 С. [5]
Получается при взаимодействии бериллия с хлором. [6]
В данной работе исследуется взаимодействие бериллия с лиметилфосфиновой и метилфосфоновой кислотами. Если в настоящее время в основном известен механизм взаимодействия карбоксилат-ной группировки с различными ионами металлов [10], то этого нельзя сказать о фосфоновой группировке. В силу стерео-специфичности фосфоновой группировки [11] по сравнению с карбоксилатной [12] можно ожидать большего разнообразия вариантов взаимодействия ее с катионами. [7]
Защитная оксидная пленка препятствует взаимодействию бериллия ( 298 - - Ij85 В) с водой. [8]
Защитная оксидная пленка препятствует взаимодействию бериллия ( Е - 1 70 в) с водой. [9]
Карбид бериллия Ве2С образуется при взаимодействии бериллия с углеродом при температурах выше температуры плавления металла. [10]
С целью выяснения механизма комплексообразования было исследовано взаимодействие бериллия с метилендифосфоновой и гек-саметилендифосфоновой кислотами. Высокие значения логарифмов констант устойчивости комплексов Be2L2 подтвердили, что природа комплексов во всех случаях одна и та же; процесс комплексообразования обусловлен координацией бериллия только с фосфоно-выми группировками. [11]
С целью выяснения механизма комплексообразования, наряду с фосфо-ршшрованными производными полиаминов было исследовано взаимодействие бериллия с метилфосфоновой и гексаметилендифосфоновой кислотами. Высокие константы устойчивости комплексов Be2L2 ( IgK - 15) подтверждают, что природа комплексов во всех случаях одна и та же: процесс взаимодействия обусловлен координацией беррилия только с фосфоновыми группировками. [12]
Основную роль в изменении объема изделий из оксида бериллия играет гелий, а также тритий, образующиеся при взаимодействии бериллия с быстрыми нейтронами. [14]
Бериллий растворяется при комнатной температуре во всех неорганических кислотах, кроме азотной. В азотной кислоте образуется защитная окисная пленка, которая препятствует взаимодействию бериллия с кислотой. Однако защитная пленка разрушается при нагревании, и бериллий начинает реагировать с азотной кислотой при повышенных температурах. Бериллий обладает хорошей коррозионной стойкостью в расплавленном висмуте, свинце, литии и калии до 600 С. [15]
Страницы: 1 2