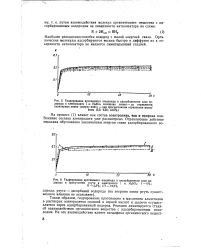
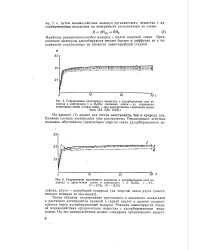
Взаимодействие - органическое вещество
Cтраница 3
А ведь здесь речь идет в сущности о немногих линейных закономерностях, представляющих частные примеры только первого и второго методов сравнительного расчета и только в применении к взаимодействию органических веществ. Какие же возможности открывает вся система методов сравнительного расчета в применении ко всему многообразию веществ и процессов органической и неорганической химии. [31]
Исследования, проведенные на пористых электродах с весьма развитой реакционной поверхностью ( скелетный никель, палладированиый уголь, палладиро-ванный скелетный никель) в концентрированных растворах органических веществ с использованием газометрической методики, показали, что взаимодействие органических веществ с электродом может идти двумя параллельными путями: посредством каталического разложения и электрохимической реакции. Смешанный механизм электродных реакций наблюдается и при электроокислении гидразина в водных растворах. Обсуждаются особенности электродных процессов перекиси водорода в кислом растворе на угольных электродах. [32]
Бром растворим в спирте, эфире, бензоле, хлороформе, сероуглероде, четыреххлористом углероде, четыреххлористом титане. Взаимодействие органических веществ с бромом сопровождается сильным разогревом, а в отдельных случаях самовоспламенением. Насыщенный водный раствор брома имеет желто-бурую окраску и называется бромной водой. При стоянии на свету из бромной воды выделяется кислород, а при нагревании - бром. Бром - сильный окислитель: он окисляет сульфиты и тиосульфа-ты в водных растворах до сульфатов, нитриты до нитратов, аммиак до свободного азота. Бром вытесняет иод из его соединений, но сам вытесняется из своих соединений хлором и фтором. Свободный бром выделяется из водных растворов хромидов также под действием сильных окислителей ( I C Cv, КМпО4 и др.) в кислой среде. При растворении брома в щелочах на холоду образуется бромид и гнпобромиг, а при повышении температуры ( около 100 С) - бромид и бромат. [33]
Химизм взаимодействия органического вещества с иони-том может быть различным ( ионный обмен, комплексообразование с противоионом или с функциональными группами полимерного каркаса, молекулярная сорбция), но в конечном итоге должен обеспечивать необходимую прочность связи. [34]
Эти соединения затем и приводят к образованию пирита. Менее легко протекает взаимодействие органических веществ с сероводородом и элементарной серой, особенно при невысоких температурах. Но что такие реакции с образованием простых и сложных органических сернистых соединений могут происходить в водной среде при невысоких температурах, подтверждается опытами, проводившимися А. С. Ве-ликовским и Е. Ф. Рудаковой, которые изучали действие элементарной серы и сероводорода на непредельные и предельные углеводороды. Они установили, что сероводород, действуя при обычной температуре на непредельные полимеры, ведет к образованию органических сернистых соединений. [35]
Таким образом, гидрирование кротонового и масляного альдегидов в растворах электролитов соляной и серной кислот и щелочи осуществляется через адсорбированный водород. Реакция лимитируется стадией взаимодействия органического вещества с адсорбированным водородом. [37]
Таким образом, гидрирование кретонового и масляного альдегидов в растворах электролитов соляной и серной кислот и щелочи осуществляется через адсорбированный водород. Реакция лимитируется стадией взаимодействия органического вещества с адсорбированным водородом. [39]
При окислении органических веществ сами кислоты восстанавливаются. Так, при взаимодействии органических веществ с азотной кислотой выделяются окислы азота и раствор окрашивается в желтый цвет, при взаимодействии с серной кислотой выделяется двуокись серы и происходит постепенное потемнение раствора. [40]
Каталитический эффект связывается с взаимодействием органических веществ с ионами высшей валентности по реакции (8.31) при последующем окислении на электроде восстановленной формы переносчика. Предполагается, что частицы молибдата и перрената адсорбированы на электроде. [42]
Адсорбция органического субстрата также приводит к деформации его молекулы с разрыхлением и разрывом связей и к образованию связей с катализатором. Изучение нестойких соединений, образующихся при взаимодействии органических веществ с катализатором на его поверхности и неразрывно связанных с ним, является очень трудной задачей. Тем не менее аналогии между гетерогенными и гомогенными, катализируемыми и некатализируемыми реакциями в сочетании с данными физико-химических исследований позволили представить вероятную структуру поверхностных соединений и, используя эти представления, объяснить важнейшие экспериментально установленные химические особенности процесса гидрирования. [43]
Руфф и Кейм [248] исследовали действие пятифтористого иода на бензол; заслуживает внимания, что в результате реакции образовались именно иодбензолы; фтор-или фториодбензолы или не получились совершенно, илгт лишь в незначительных количествах. Позднее Фреденгаген и Каденбах [249] разработали условия, в которых взаимодействие органических веществ со свободным фтором может быть проведено без полного разрушения органического вещества. Аппаратура довольно сложна, и продукты реакции неоднородны, так что этот способ для препаративных целей пока не может приниматься в расчет. [44]
Руфф и Коим; [248] исследовали действие пятифториотого иода iiti Пенлол; заслуживает внимания, что в результате реакции обра-шишлись именно подбензолы; фтор - или фториодбеизолы или не получились совершенно, пли получились в малых количествах. Поадиее Фредспгаген и Каденбах [249] разработали условия, в которых взаимодействие органических веществ со свободным фтором может быть проведено Gey полного разрушения органического вещества. Аппаратура довольно сложна, и продукты реакции неоднородны, так что этот способ для препаратиипых целей пока не может приниматься в расчет. [45]
Страницы: 1 2 3 4