Направленное взаимодействие
Cтраница 3
Во всех случаях период решетки с и отношение осей с la увеличивались при образовании твердого раствора, причем это увеличение при введении одинакового количества растворяемых элементов возрастало в ряду цирконий - - ниобий - - - молибден - - палладий - родий. Отношение осей в решетке рутения ( сla 1 5824) значительно меньше идеального, и межатомные расстояния в плоскости базиса больше, чем расстояния между ближайшими соседями, расположенными в соседних плоскостях. Хеллауэлл и Юм-Розери объясняют наблюдаемые изменения периодов решетки размерными различиями между атомами компонентов, которые выражаются в различии минимальных расстояний между атомами в решетке чистых элементов, а также возможным направленным взаимодействием электронного облака циркония, которое может иметь место при образовании сплавов. [31]
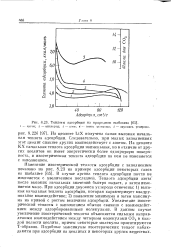 |
Теплоты адсорбции на природном шабазите. 1 - аргон. 2 - кислород. 3 - азот. 4 - окись углерода. S - двуокись углерода. [32] |
В случае аргона теплота адсорбции почти не изменяется с увеличением последней. Теплота адсорбции азота после высоких начальных значений быстро падает, э затем изменяется мало. При адсорбции двуокиси углерода отмечены: 1) высокая начальная теплота адсорбции, которая характеризует квадру-польное взаимодействие; 2) появление минимума и затем максимума на кривой с ростом величины адсорбции. Увеличение изостерической теплоты с заполнением обычно связано с взаимодействием между адсорбированными молекулами. В данном случае увеличение изостерической теплоты объясняется сильным направленным взаимодействием между четырьмя молекулами С02 в каждой полости цеолита, причем некоторые молекулы ориентируются Т - образпо. Подобные максимумы изостерических теплот наблюдаются при адсорбции на цеолитах и некоторых других веществах. [33]
Натрий в кристаллической решетке однократно ионизирован. Главной компонентой энергии решетки натрия является металлическое взаимодействие ионов с электронным газом. Если бы эти ионы имели сферическую симметрию, то вследствие ненаправленного взаимодействия их с электронным газом они упаковывались бы плотнейшим образом. Однако натрий имеет неплотную ОЦК структуру, что указывает на дополнительное направленное взаимодействие ионов. [34]
Растворение ПАВ в воде происходит главным образом за счет взаимодействия полярных групп их молекул с водой. Энергия взаимодействия неполярных участков молекулы ПАВ с водой невелика и в любом случае значительно меньше энергии вандерваальсовского притяжения углеводородных радикалов друг к другу. Под влиянием гидрофобного взаимодействия эти радикалы исключаются из структуры жидкой воды, тогда как гидрофильные группы, образуя с молекулами воды систему ион-дипольных или водородных связей, существенно влияют на структуру водного раствора. При достаточной длине неполярных радикалов или полярной и неполярной составных частей молекулы ПАВ оба эффекта - исключение из структуры жидкой воды углеводородных участков и образование систем связи гидрофильных участков с жидкой водой - протекают в основном независимо. Вследствие этого состояние молекул ПАВ в водном растворе определяется балансом противоположно направленных взаимодействий, или так называемым гидрофильно-липофильным балансом. [35]
При образовании трехзарядных ионов остальных лантаноидов наряду с повышением концентрации электронного газа до 2 эл / атом ( способствующей возрастанию энергии связи ионов, о чем можно судить, например, по повышению температур плавления при переходе от бария к лантану, от европия к гадолинию и от иттербия к лютецию) одновременно происходит сжатие внешних рв-оболочек их ионов. Это обстоятельство означает сокращение протяженности р-орбиталей, которые уже не перекрываются. Однако с повышением температуры энергия электронов на внешних р-уровнях возрастает и протяженность р-орбиталей увеличивается. Энергия же свободных электронов и, следовательно, энергия взаимодействия их с ионами существенно не изменяются. Таким образом, расширение р-орбиталей опережает увеличение межатомных расстояний, в области высоких температур наступает перекрытие р-орбиталей и возникает обменное направленное взаимодействие по осям прямоугольных координат. Это приводит к появлению объемноцентрированных кубических высокотемпературных модификаций, свойственных всем лантаноидам. Вследствие лантаноидного сжатия р6 - оболочек ионов появление объемноцентрированной модификации происходит при тем более высокой температуре, чем больше атомный номер лантаноида ( см. рис. 69, а), причем этот же фактор объясняет возрастание и их температур плавления от лантана до самария и от гадолиния до тулия и лютеция. [36]
Страницы: 1 2 3