Вандерваальсовское взаимодействие
Cтраница 1
Вандерваальсовские взаимодействия в конденсированных средах не могут приводить к образованию устойчивых комплексов и ассоциатов нескольких молекул с упорядоченным расположением атомов. Такие структуры возникают за счет слабых химических взаимодействий молекул с избранными функциональными группами, а также при определенных размерах частиц и специфическом их строении. Специфические взаимодействия известны для большого числа соединений в жидких средах. Такого рода связи сопровождаются обычно изменением спектральных свойств молекул. [1]
Вопрос о влиянии вандерваальсовских взаимодействий на коэффициенты Эйнштейна в настоящее время разработан недостаточно. [2]
Поляризуемость н постоянная вандерваальсовского взаимодействия щелочных п щелочноземельных атомов п подобных им ионов. [3]
Речь идет о расстояниях, устанавливающихся при вандерваальсовском взаимодействии атомов или групп соседних молекул. [4]
Позднее был предложен ряд новых теорий, в которых вандерваальсовские взаимодействия поглощающих молекул в среде учитывались более строго. [5]
 |
Схема электронных уровней молекулы в паре и растворе. [6] |
В настоящее время наиболее полно разработана теория о влиянии вандерваальсовских взаимодействий на положение и интенсивность электронных спектров. [7]
Как показывает анализ, существенное значение имеет форма потенциальной кривой вандерваальсовского взаимодействия молекул данного вещества. Если бы число этих индивидуальных констант не превышало двух, то они могли бы быть исключены ( с помощью двух условий, определяющих критическую точку) из уравнения состояния и последнее могло бы быть приведено к безразмерному выражению, не содержащему никаких констант, зависящих от природы вещества. [8]
Этот экзоэффект эквивалентен в выражении Бернала и Фаулера члену, учитывающему вандерваальсовское взаимодействие внутри сольвата. [9]
Два или несколько веществ термодинамически подобны, если кривые потенциальной энергии вандерваальсовского взаимодействия двух молекул в зависимости от расстояния между их центрами геометрически подобны. [10]
Два или несколько веществ термодинамически подобны, если кривые потенциальной энергии вандерваальсовского взаимодействия двух молекул в зависимости от расстояния между их центрами геометрически подобны. Если учесть, что в это выражение в первом приближении входят три индивидуальные константы, характеризующие природу вещества, то можно установить более частный, но вместе с тем и более практически значимый признак термодинамического подобия, который можно сформулировать следующим образом. [11]
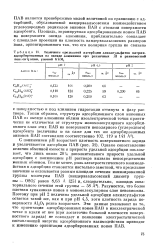 |
Величины предельной адсорбции алкилсульфатов натрия, адсорбированных на оксиде алюминия при различных II и равновесной концентрации, равной К КМ. [12] |
ПАВ является пренебрежимо малой величиной по сравнению с адсорбцией, обусловленной вандерваальсовским взаимодействием углеводородных радикалов анионов ПАВ с атомами поверхности адсорбента. [13]
Как показывает анализ этого вопроса, существенное значение имеет форма потенциальной кривой вандерваальсовского взаимодействия молекул данного вещества. [14]
Изменения перечисленных параметров молекул могут происходить в слабоактивных растворителях, где в основном преобладают вандерваальсовские взаимодействия, и при комплексообразовании. [15]
Страницы: 1 2 3 4