Протолитическое взаимодействие
Cтраница 1
Протолитическое взаимодействие иона Са2 с водой происходит в очень небольшой степени и им можно пренебречь, так же как протолитическим взаимодействием НСОг с водой. [1]
Протолитическое взаимодействие иона Са2 с водой происходит в очень небольшой степени и им можно пренебречь, так же как протолитическим взаимодействием НСОГ с водой. [2]
Протолитическое взаимодействие анионов многоосновных кислот происходит ступенчато. [3]
Кислотно-основное или протолитическое взаимодействие состоит в обратимом переносе протона от молекулы ( нейтральной или заряженной) кислоты к молекуле основания. [4]
 |
Колоколообразная зависимость константы ско - ОДНОЙ И ТОЙ Же реакции С РОСТОМ рН рости реакции от рН раствора. [5] |
Сначала происходит протолитическое взаимодействие одного из реагентов с катализатором-гидроксонием. Образуется прото-нированная форма этого вещества, обладающая повышенной реакционной способностью, которая затем вступает во взаимодействие со вторым реагентом с одновременной передачей протона молекуле воды и регенерацией гидроксония. [6]
Так, в протолитическом взаимодействии грамм-эквивалент какого-либо протолита представляет собой массу протолита. [7]
Последние практически не вступают в протолитическое взаимодействие с растворенным электролитом. [8]
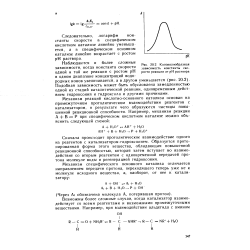 |
Колоколообразная зависимость константы скорости реакции от рН раствора. [9] |
Механизм реакций кислотно-основного катализа основан на промежуточном протолитическом взаимодействии реагентов с катализатором, в результате чего образуются частицы повышенной реакционной способности. [10]
 |
Колоколообразная зависимость константы ско - ОДНОЙ И ТОЙ Же реакции С РОСТОМ рН рости реакции от рН раствора. [11] |
Механизм реакций кислотно-основного катализа основан на промежуточном протолитическом взаимодействии реагентов с катализатором, в результате чего образуются частицы повышенной реакционной способности. [12]
При растворении в амфипротонных растворителях кислоты и основания вступают в протолитическое взаимодействие с растворителем. Вследствие этого изменяется активность ( концентрация) ионов лиония и рН раствора в большей или меньшей степени отличается от рН нейтральной среды. Кроме того, раствор имеет определенные буферные свойства. При рассмотрении всех этих вопросов целесообразно растворимые протолиты подразделить на сильные и слабые. [13]
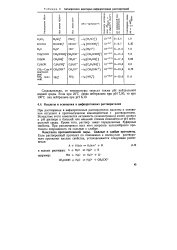 |
Автопротолиз некоторых амфипротонных растворителей. [14] |
При растворении в амфипротонных растворителях кислоты и основания вступают в протолитическое взаимодействие с растворителем. Вследствие этого изменяется активность ( концентрация) ионов лиония и рН раствора в большей или меньшей степени отличается от рН нейтральной среды. Кроме того, раствор имеет определенные буферные свойства. При рассмотрении всех этих вопросов целесообразно про-толиты подразделить на сильные и слабые. [15]
Страницы: 1 2